МОУ«Средняя общеобразовательная школа № 36»
Тема: Белки
(лекция в 10 кл.)
"Жизнь - это форма существования белка"

Оборудование
Реактивы: яичный белок, натуральный шелк, шерсть, гидроксид натрия, сульфат меди. конц. азотная кислота, этиловый спирт, вода, раствор хлорида натрия..
Оборудование: спички, спиртовка, лучинка, стакан, компьютер, проектор, экран, учебник, таблицы, штатив, пробирки.

План лекции
- Белки в природе.
2. Классификация белков.
3. Состав и строение белков.
4. Свойства белков.
5. Функции белков.

Цель лекции
На основе углубления межпредметных связей химиии биологии показать единство и взаимосвясь живой и неживой материи, их состав. Свойства белка: гидролиз, денатурация, цветные реакции белков, превращение белков пищи в организме .

Белки в природе
Белки в природе составляют наиболее важную составную часть всех организмов растений, животных и человека. Они разнообразны по форме, структуре, функциям.
Состав белков в тканях неоднороден, да кроме того он индивидуален для каждого организма. Это тайна. Разгадать эту тайну очень трудно, т.к. белок – сложное органическое соединение.
Белок – «полимер» - мономером которого является аминокислоты. Установлено, что 20 аминокислот. Путем разной комбинации входят в состав клеток животных, человека, растений. Судьба аминокислот в организме различна: разрушаются, подвергаются гидролизу, рекомбинируются.
Белки в природе
Белками , или белковыми веществами , называют высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот, связанных пептидной связью -СО-NH- . Белки – основная и необходимая составная часть всех организмов. Сухое вещество большинства органов и тканей человека и животных, а также большая часть микроорганизмов состоят главным образом из белков. Микроорганизмы обычно богаче белком (некоторые же вирусы являются почти чистыми белками). К белкам относятся и сократительные структуры, лежащие в основе движения. Н - р, сократительный белок мышц, опорные ткани организма (коллаген костей, хрящей, сухожилий), покровы организма (кожа, волосы, ногти и т.п.), состоящие главным образом из коллагенов, эластинов, кератинов, а также токсины, антитела, многие гормоны и другие биологически важные вещества. Свое название белки получили от яичного белка, который с незапамятных времен использовался человеком как составная часть пищи. Среди белков животного происхождения, вслед за яичным белком, были охарактеризованы белки крови. Среди растительных белков пальма первенства принадлежит нерастворимой в воде клейковине из пшеничной муки.
- Белками , или белковыми веществами , называют высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот, связанных пептидной связью -СО-NH- . Белки – основная и необходимая составная часть всех организмов. Сухое вещество большинства органов и тканей человека и животных, а также большая часть микроорганизмов состоят главным образом из белков. Микроорганизмы обычно богаче белком (некоторые же вирусы являются почти чистыми белками). К белкам относятся и сократительные структуры, лежащие в основе движения. Н - р, сократительный белок мышц, опорные ткани организма (коллаген костей, хрящей, сухожилий), покровы организма (кожа, волосы, ногти и т.п.), состоящие главным образом из коллагенов, эластинов, кератинов, а также токсины, антитела, многие гормоны и другие биологически важные вещества. Свое название белки получили от яичного белка, который с незапамятных времен использовался человеком как составная часть пищи. Среди белков животного происхождения, вслед за яичным белком, были охарактеризованы белки крови. Среди растительных белков пальма первенства принадлежит нерастворимой в воде клейковине из пшеничной муки.

Содержание белка в тканях различных органов
Особенно много белков в тканях животных, в яйцах и в семенах, в грибах .
Ткань
Содержание белка в % от сухой массы ткани
Селезенка
Легкие
Мышцы
Почки
Печень
Головной мозг
Кишечник
Кожа
Кости
Зубы
84
82
80
72
60
57
63
63
28
24
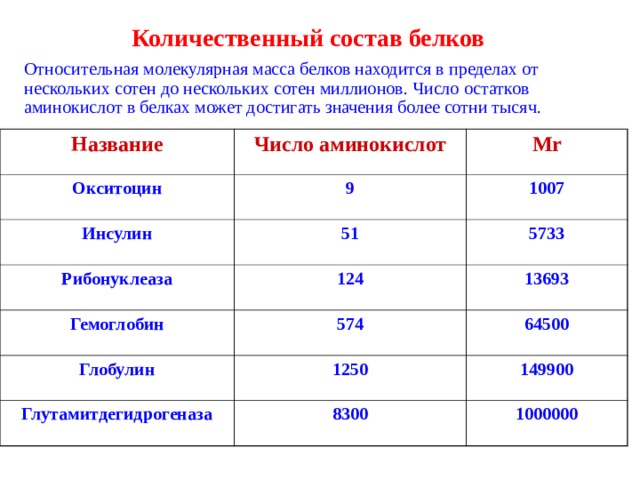
Количественный состав белков
Относительная молекулярная масса белков находится в пределах от нескольких сотен до нескольких сотен миллионов. Число остатков аминокислот в белках может достигать значения более сотни тысяч.
Название
Число аминокислот
Окситоцин
М r
9
Инсулин
51
Рибонуклеаза
1007
5733
124
Гемоглобин
574
13693
Глобулин
64500
1250
Глутамитдегидрогеназа
8300
149900
1000000

Состав белков
Элементный состав белков
Белки содержат азот, углерод, кислород, водород, серу. В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие . Пенициллин - C 16 H 18 O 4 N 3
Молоко - C1 864 H 3021 O 576 N 466 S 21
Гемоглобин - C 3032 H 4876 O 672 N 780 S 6 Fe 4
Первым из "настоящих" белков, структуру которого удалось расшифровать, был гормон инсулин, регулирующий содержание сахара в крови. Для расшифровки структуры инсулина, потребовалось 10 лет упорного труда. Оказалось, что инсулин состоит из двух полипептидных цепей, содержащих 21 и 30 полипептидных остатков, соединенных дисульфидными -S-S- связями.

Аминокислоты
В настоящее время в различных объектах живой природы обнаружено до 200 различных аминокислот. В организме человека их, например, около 60. Однако в состав белков входят только 20 аминокислот, называемых иногда природными. Аминокислоты — органические кислоты, у которых атом водорода -углеродного атома замещен на аминогруппу – NH 2 . Следовательно, по химической природе это -аминокислоты с общей формулой: COOH
H – C *– NH 2
R
Из формулы видно, что в состав всех аминокислот входят следующие общие группировки: – C О–, – NH 2 , – COOH . Боковые же цепи (радикалы – R ) аминокислот различаются. Природа радикалов разнообразна: от атома водорода до циклических соединений. Именно радикалы определяют структурные и функциональные особенности аминокислот.
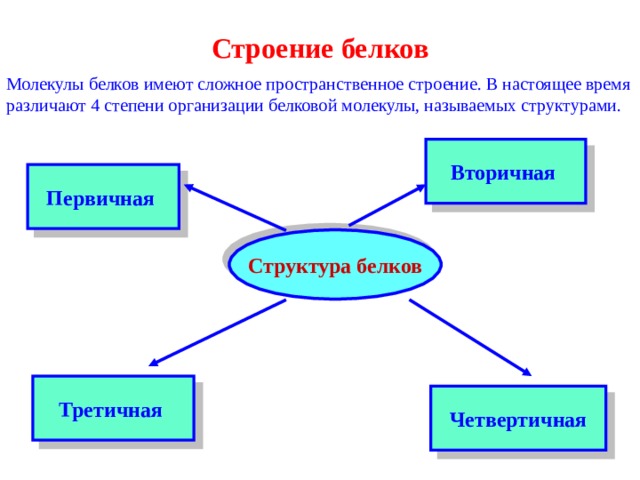
Строение белков
Молекулы белков имеют сложное пространственное строение. В настоящее время различают 4 степени организации белковой молекулы, называемых структурами.
Вторичная
Первичная
Структура белков
Третичная
Четвертичная
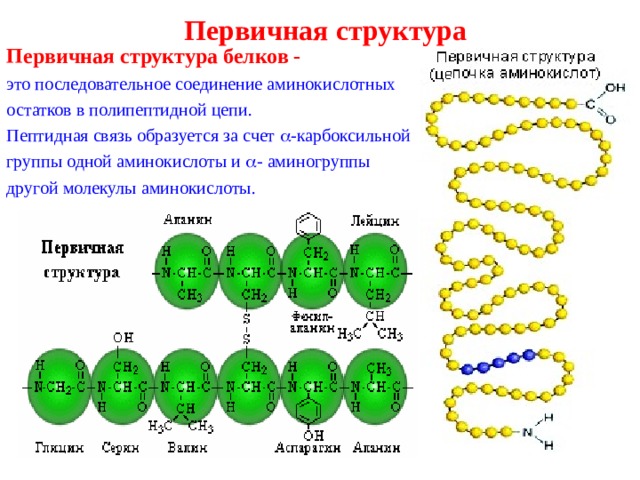
Первичная структура
Первичная структура белков -
это последовательное соединение аминокислотных
остатков в полипептидной цепи.
Пептидная связь образуется за счет -карбоксильной
группы одной аминокислоты и - аминогруппы
другой молекулы аминокислоты.
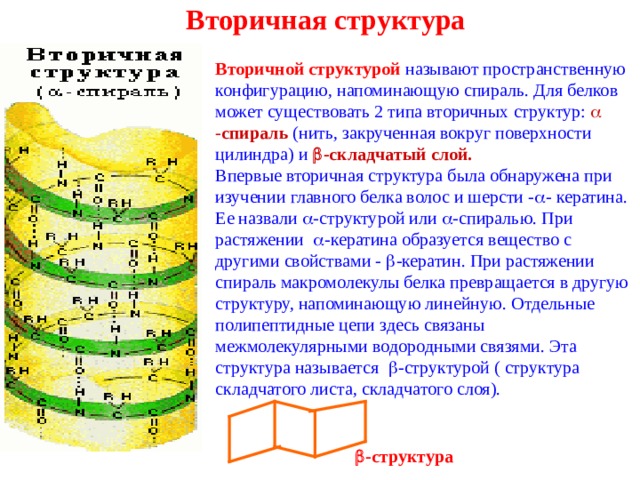
Вторичная структура
Вторичной структурой называют пространственную конфигурацию, напоминающую спираль. Для белков может существовать 2 типа вторичных структур: - спираль (нить, закрученная вокруг поверхности цилиндра) и -складчатый слой.
Впервые вторичная структура была обнаружена при изучении главного белка волос и шерсти - - кератина. Ее назвали -структурой или -спиралью. При растяжении -кератина образуется вещество с другими свойствами - -кератин. При растяжении спираль макромолекулы белка превращается в другую структуру, напоминающую линейную. Отдельные полипептидные цепи здесь связаны межмолекулярными водородными связями. Эта структура называется -структурой ( структура складчатого листа, складчатого слоя).
-структура

Третичная структура
Третичная структура - это в пространстве закрученная спираль. По характеру «упаковки» белковой молекулы различают молекулы глобулярные (или шаровидные ), и фибриллярные ( или нитевидные),белки. Для глобулярных белков характерны -спиральная структура. Для фибриллярных белков характерна нитевидная структура.
Среди связей, удерживающих третичную структуру, следует отметить:
а) дисульфидный мостик (– S – S –) между двумя остатками цистеина;
б) сложноэфирный мостик (между карбоксильной группой и гидроксильной группой);
в) солевой мостик (между карбоксильной группой и аминогруппой);
г) водородные связи между группами -СО - и - NH -;
Третичной структурой объясняется специфичность белковой молекулы, ее биологическая активность .
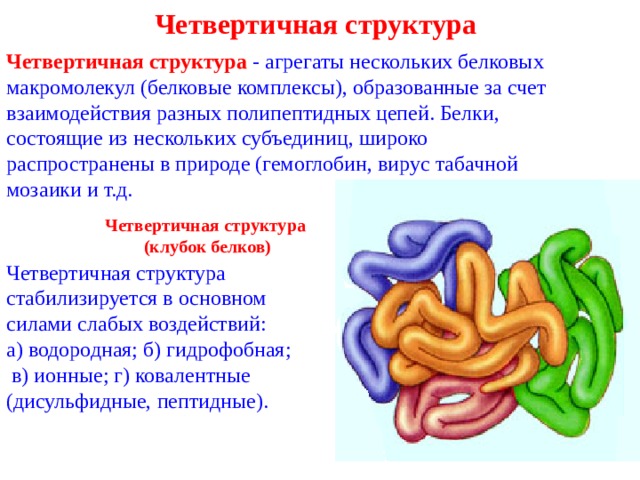
Четвертичная структура
Четвертичная структура - агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей. Белки, состоящие из нескольких субъединиц, широко распространены в природе (гемоглобин, вирус табачной мозаики и т.д.
Четвертичная структура
(клубок белков)
Четвертичная структура стабилизируется в основном силами слабых воздействий:
а) водородная; б) гидрофобная;
в) ионные; г) ковалентные (дисульфидные, пептидные).
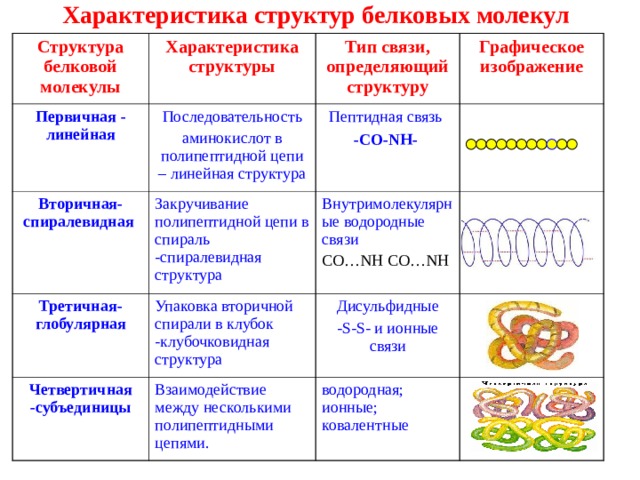
Характеристика структур белковых молекул
Структура белковой молекулы
Характеристика структуры
Первичная - линейная
Тип связи, определяющий структуру
Последовательность
аминокислот в полипептидной цепи – линейная структура
Вторичная- спиралевидная
Графическое изображение
Третичная- глобулярная
Пептидная связь
- С O-NH -
Закручивание полипептидной цепи в спираль -спиралевидная структура
Упаковка вторичной спирали в клубок -клубочковидная структура
Четвертичная -субъединицы
Внутримолекулярные водородные связи
Дисульфидные
-S-S- и ионные связи
Взаимодействие между несколькими полипептидными цепями.
С O … NH С O … NH
водородная; ионные; ковалентные

Денатурация белков
Фильм № 1
Денатурация белков - это разрушение их природной пространственной структуры с сохранением первичной структуры, приводящее к дезориентации конфигурации белковой молекулы, снижением или полной потерей биологической функции.
Различают физические (температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучения) и химические (тяжелые металлы, кислоты, щелочи, органические растворители) факторы, вызывающие денатурацию.
Фильм № 2
Необратимая денатурация белка
Фильм № 3
Денатурированный белок
Нативный (природный) белок
Денатурация белков
В пищевой технологии особое практическое значение имеет тепловая денатурация белков. Всем хорошо известный пример тепловой денатурации – «свертывание» яичных белков при варке яиц. В результате разрыва водородных связей денатурированный белок теряет растворимость, после чего первоначальная структура уже не может быть восстановлена. С денатурацией встречаемся и при приготовление пищи, при сушке зерна, выпечке хлеба, получении макаронных изделий, при взбивании ячного белка для приготовления тортов и т д.. Денатурированный белок лучше усваивается организмом.
Денатурация белков положена в основу лечения отравления тяжелыми металлами, когда больному вводят (“через рот”) молоко или сырые яйца с тем, чтобы металлы адсорбировались на поверхности денатурирующего белка и не действовали на белки слизистой оболочки желудка и кишечника, а также не всасывались в кровь.
Денатурация белка может быть и отрицательной. Так например, при повышенной температуре у человеке может произойти свертывание крови. При транспортировке крови контейнер должен быть устойчивым, чтобы не вызвать денатурацию.
Фильм № 4
без звука

Свойства белков
а) Физические свойства.
Белки бывают растворимые и нерастворимые в воде, некоторые из них с водой образуют коллоидные растворы.
Лабораторные опыты.
Растворимость белков в воде и растворе хлорида натрия.
Важнейшим свойством белков является их способность проявлять как кислые, так и основные свойства, то есть выступать в роли амфотерных электролитов . Это обеспечивается за счет различных диссоциирующих группировок, входящих в состав радикалов аминокислот. Например, кислотные свойства белку придают карбоксильные группы аспарагиновой и глутаминовой аминокислот, а щелочные — радикалы аргинина, лизина и гистидина. Чем больше дикарбоновых аминокислот содержится в белке, тем сильнее проявляются его кислотные свойства и наоборот.

Химические свойства белков
1. Реакция горения.
Белки горят с образованием азота, углекислого газа и воды .
Белок + O 2 = N 2 + CO 2 + H 2 O
Горение сопровождается запахом жженых перьев а также некоторых других веществ. Например, белки шерсти имеют дисульфидные мостики –S-S- между молекулами. Человеческие волосы- это та же шерсть. Лишь слегка отличается от овечьей. В парикмахерских при химической горячей завивке разрушаются дисульфидные мостики и в процессе завивке выделяются низкомолекулярные органические соединения серы, которые придают нагретым волосам (шерсти) их характерный запах. При глажении шерсти также выделяется характерны запах серы.

Химические свойства белков
2. Гидролиз белков
Гидролизом называют процесс разрушения пептидных связей белковой молекулы с участием воды.
Мясо состоит главным образом из белков. У старых животных белковые цепи соединены между собой поперечными сшивками и поэтому не могут больше двигаться. Говядина становится жесткой и хуже усваивается. Чтобы сделать ее мягче, сетку нужно расщепить на более мелкие фрагменты. Это происходит при гидролизе. Для белков гидролиз сопровождается расщеплением пептидных связей – С O - NH -
Схема следующая:
NH 2 — СН R —С O — NH —С HR / + nH 2 O
NH 2 —СН R —С OO Н + NH 2 —С HR / —С O ОН
Такой процесс происходит при длительном тушение мясных блюд. Можно ускорить гидролиз, добавляя определенные энзимы, например бромелин, который содержится в свежих ананасах. Энзимы- белки, обладающие каталитическим действием. С гидролизом белков мы встречаемся каждый день на кухне. Варим мясной бульон (пена), макароны, лопаются яйца и вытекший белок сворачивается.
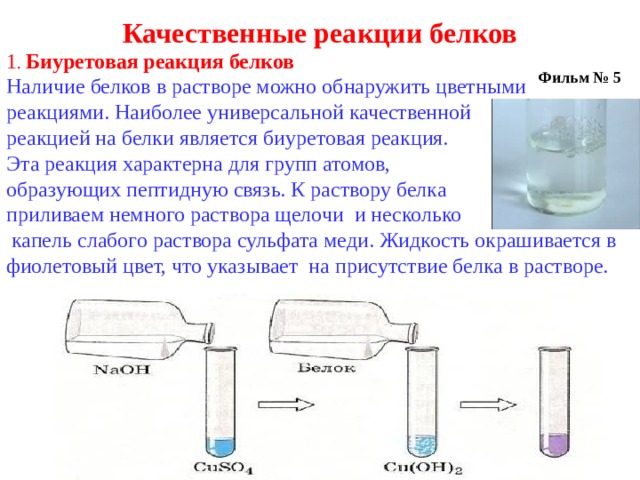
Качественные реакции белков
1 . Биуретовая реакция белков
Наличие белков в растворе можно обнаружить цветными реакциями. Наиболее универсальной качественной
реакцией на белки является биуретовая реакция.
Эта реакция характерна для групп атомов,
образующих пептидную связь. К раствору белка
приливаем немного раствора щелочи и несколько
капель слабого раствора сульфата меди. Жидкость окрашивается в фиолетовый цвет, что указывает на присутствие белка в растворе.
Фильм № 5

Качественные реакции белков
2. Ксантопротеиновая реакция , при действии концентрированной азотной кислотой белки окрашиваются в желтый цвет. Эта реакция доказывает, что в состав белков входят остатки ароматических аминокислот.
? Какую первую помощь необходимо оказать при попадание на кожу азотной кислотой.
Фильм № 6

Классификация белков
Из-за относительно больших размеров белковых молекул, сложности их строения еще нет рациональной химической классификации белков. Существует несколько классификаций белков. В их основе лежат разные признаки:
- по степени сложности (простые (протеины) и сложные(протеиды) ) ;
- по форме молекул (глобулярные и фибриллярные белки);
- по растворимости (растворимые в воде, кислотах, щелочах, солях, в спиртах);
- по выполняемым функциям (запасные белки, скелетные и т.п.).

По степени сложности
Простые белки или протеины представляют собой простые белки, состоящие только из остатков аминокислот. Они широко распространены в животном и растительном мире. Растительные белки, содержащиеся в клейковине семян злаковых и некоторых других, в зеленых частях растений.
Например: альбумины, содержатся в сыворотке крови, молоке, яичном белке. Глобулины содержатся в семенах растений, особенно в бобовых и масленичных; в плазме крови и в некоторых других биологических жидкостях .
Сложные белки, или протеиды, помимо остатков аминокислот, содержат также небелковые молекулы. Например: фосфопротеины имеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, белок желтков яиц.

Схема практического значения белков
Транспортные
Энергетическая
Каталитическая
Строительная
Гормоны
Защитные
Белки
Рецепторные
Двигательные
Запасные
Токсины
Антибиотики

Функции белка
В клетках постоянно происходят два процесса: созидания и разрушения. Основная функция белка созидания - строительная. Белки – это строительный материал почти всех тканей: мышечных, опорных, покровных и т.д. Пример структурного белка - фиброин шелка, выделяемый гусеницами шелкопряда в период формирования куколки и являющийся основным компонентом шелковых нитей. Из белков состоят мембраны (оболочки) всех клеток, стенки кровеносных сосудов, сухожилия, хрящи.
Ферментативная функция (каталитическая). Ферменты повышают скорость хим. реакции в организме. Каждой реакции присущ свой фермент- белок. А в клетке тысяча реакций, соответственно и тысяча ферментов присуще клетке.
Сигнальная функция – служит для восприятия и преобразования различных сигналов, поступающих в клетку, как от окружающей среды, так и от других клеток. В ответ на факторы внешней среды белка мембраны способны изменять третичную структуру в другие структуры.
Двигательная – сокращение мышц, движение живых организмов.

Транспортная функция - способствует переносу органических и неорганических соединений из клеток в клетки. Важнейшим транспортным белком является гемоглобин крови, который переносит кислород.
Защитная функция- белки обезвреживают чужеродные вещества в клетке.
Энергетическая – при распаде белков до аминокислот выделяется энергия, которая здесь же в клетках , тканях может быть использована на все перечисленные функции.
Токсины
Ряд живых организмов в качестве защиты от потенциальных врагов вырабатывают сильно ядовитые вещества - токсины. Многие из них являются белками. В качестве примера такого вещества можно привести ядовитое начало бледной поганки- -аманитин.

Закрепление материала
- Каковы особенности первичной структуры белка? Приведите пример.
- В чем проявляется вторичная и третичная структура белка?
3. Какова роль водородной связи для белковых молекул?
4. В чем суть денатурации белков?
5. Какие вещества образуются при полном гидролизе белков?
а) Карбоновые кислоты; б) амины;
в) нуклеиновые кислоты; г) аминокислоты.
6. Какие цветные реакции белков вам известны?
7. Как практически отличить шерстяную ткань от хлопчатобумажной?

Вывод
Доказано, что белки - обязательная составная часть всех живых клеток, играют исключительно важную роль в живой природе, являются главным, наиболее ценным и незаменимым компонентом питания. Это связанно с той огромной ролью, которую они играют в процессах развития и жизни человека. Белки являются основой структурных элементов и тканей, поддерживают обмен веществ и энергии, участвуют в процессах роста и размножения, обеспечивают механизмы движений, развитие иммунных реакций, необходимы для функционирования всех органов и систем организма.

Литература
- «1C: Образовательная коллекция. Органическая химия. 10-11 классы».
- Единая коллекция цифровых образовательных ресурсов. http :// www . edu . yar . ru
- CD Уроки химии КиМ (10-11 класс).

 Получите свидетельство
Получите свидетельство Вход
Вход












 Тема урока: "Белки". (1.4 MB)
Тема урока: "Белки". (1.4 MB)
 0
0 738
738 15
15 Нравится
0
Нравится
0


