Предмет: Химия
Класс: 9
Тип урока: Урок открытия новых знаний.
УМК: Химия. О. С. Габриелян, С.А.Сладков, И.Г. Остроумов
Тема: "Соединения щелочных металлов"
Цель урока: создание условий для восприятия и первичного закрепления нового учебного материала, осмысление связей и отношений в объектах изучения.
Задачи урока:
формирование представления о соединениях щелочных металлов, их физических и химических свойствах, областях применения и значении для организма
формирование личностных УУД (установление взаимосвязи между целью учебной деятельности и ее мотивом)
развитие умений проведения химического эксперимента с соблюдением правил техники безопасности, построения логических цепочек и умения делать выводы из наблюдений, прогнозировать решение некоторых проблем;
развитие регулятивных УУД (целеполагание, планирование, прогнозирование, коррекция и оценка деятельности)
развитие познавательных УУД (поиск и выделение необходимой информации, моделирование, выбор наиболее эффективных способов решения задач в зависимости от условий, восприятие текстов, анализ, синтез, сравнение, выведение следствий, установление причинно-следственных связей,, доказательство и обоснование)
развитие коммуникативных УУД (учебное сотрудничество с учителем и сверстниками)
Планируемый результат:
Личностные УУД:
- определять общие для всех правила поведения;
- определять правила работы в группах;
- оценивать усваиваемое содержание (исходя личностных ценностей);
- устанавливать связь между целью деятельности и ее результатом.
Регулятивные УУД:
- определять и формулировать цель деятельности на уроке;
- проговаривать последовательность действий на уроке; работать по плану, инструкции;
- высказывать свое предположение на основе учебного материала;
- осуществлять самоконтроль;
- совместно с учителем и одноклассниками давать оценку деятельности на уроке.
Познавательные УУД:
- ориентироваться в учебнике;
- ориентироваться в своей системе знаний (определять границы знания/незнания);
- находить ответы на вопросы в тексте, иллюстрациях, используя свой жизненный опыт;
- проводить анализ учебного материала;
- проводить классификацию, указывая на основание классификации;
Коммуникативные УУД:
- слушать и понимать речь других;
- уметь с достаточной полнотой и точностью выражать свои мысли;
- умение донести информацию кратко, четко
Предметные умения
Научатся: характеризовать свойства важнейших соединений щелочных металлов.
Получат возможность: научиться применять соединения щелочных металлов
| Этапы урока | Деятельность учителя | Деятельность учащихся | Планируемые результаты | ||||||||||||||||||||||||||||||||||||||||||
| 1. Организационный момент. | Приветствует учащихся, проверяет готовность к уроку | Приветствуют учителя, осуществляют самопроверку готовности к уроку | Личностные УУД: формирование навыков самоорганизации, эмоциональный настрой на урок | ||||||||||||||||||||||||||||||||||||||||||
| 2. Актуализация опорных знаний и умений (Повторение пройденного) | 1.Составьте кластер по положению щелочных металлов в таблице, вспомните особенности строения атомов.(2 учащихся выходят к доске) (На задание отводится 4 мин.) Щелочные металлы занимают 1 А группу в ПСХЭ, имеют по 1 электрону на внешнем электронном уровне, s-элементы, в сложных веществах проявляют с.о.+1.В группе за счет увеличения атомного радиуса от лития к цезию увеличивается способность отдавать электроны, т.е. восстановительная способность. 2.Назовите физические свойства щелочных металлов, особенности их хранения. Щелочные металлы имеют металлический блеск, легкие ,пластичные, мягкие, хорошо проводят тепло и электрический ток, имеют низкие температуры кипения и плавления. Хранятся под слоем керосина из-за высокой химической активности, чтобы избежать взаимодействие с кислородом воздуха, литий хранится в вазелине, т.к в керосине он всплывает. Каждая пара учащихся выполняет тестовое задание 1 в рабочем листе. Работают по 2 вариантам по пройденной теме "Щелочные металлы" (Приложение 1). (На тест отводится 6 минут). По окончании проводят взаимоконтроль по слайду. Оценка будет выставляться по общему количеству набранных баллов за весь урок. «5»-12-15 баллов «4»-8-11 баллов «3»-менее 7 баллов | Учащиеся по слайдам презентации составляют кластеры по положению щелочных металлов в ПСХЭ, особенностях строения внешнего электронного слоя и их физическим свойствам, затем выполняют тестовое задание по вариантам, осуществляют взаимоконтроль по ответам на слайде. | Познавательные УУД: активизация имевшихся ранее знаний; Коммуникативные УУД: формирование умения оценивать работу товарищей | ||||||||||||||||||||||||||||||||||||||||||
| 3. Мотивация к изучению нового материала.
4. Усвоение новых знаний | 1. А можно ли встреть щелочные металлы в свободном виде в природе? Почему? 2. Предположите, в виде каких соединений они могут находиться в природе? В природе щелочные металлы встречаются только в виде соединений. Na и К в природе встречаются в виде хлоридов, сульфатов, силикатов и т.д. Li, Rb, Cs входят в состав различных минералов. Fr встречается в радиоактивных рудах. 3. На слайде находятся объекты, содержащие соединения щелочных металлов (сода, соль, пальчиковые батарейки, мыло). Посмотрите на эти объекты. Как вы думаете, что их объединяет? 4. О чем мы еще не успели поговорить? Это и будет темой нашего урока.(4 мин.) Тема урока "Соединения Щ.М."
Учитель сообщает о 4 основных этапах изучения новой темы. 1.Этап. Рассматриваются физические свойства оксида натрия. Выдается шпаргалка, по которой обучающиеся записывают химические свойства оксида натрия, как основного оксида. Проверяют по слайду. 1. Написать уравнение реакции оксида натрия с водой. Na2O + H2O = 2NaOH Ребята в рабочем листе записывают уравнения химической реакции. 2. Написать уравнение реакции оксида натрия с серной кислотой Na2O + H 2SO4 = Na2SO4 + H2O Ребята в рабочем листе записывают уравнения химической реакции. 3. Написать уравнение реакции оксида натрия с оксидом углерода (IV),оксидом цинка при нагревании и без нагревания с водой, с гидроксидом цинка при нагревании и в растворе. Na2O + CO2 = Na2CO3 Na2O + ZnO → Na2ZnO2 Na2O + ZnO+2H2O → Na2[Zn(OH)4] Na2O + Zn(OH) 2 →Na2ZnO2 + H2O Na2O+Zn(OН)2+H2O→Na2[Zn(OH)4] Последние 4 реакции записывают с учителем. Сделайте вывод о химических свойствах оксидов щелочных металлов. ВЫВОД: оксиды ЩМ способны реагировать с кислотами, кислотными и амфотерными оксидами, водой.(6мин) 2 этап. Повторяет с учащимися правила работы с растворами кислот и щелочей: как наливать растворы, сколько их брать, куда девать излишки растворов, как встряхнуть содержимое пробирки, что делать, если раствор пролит? Обсуждают качественный состав гидроксида натрия и предполагают его качественные реакции. Выполняют задание по изучению химических свойств гидроксида натрия, как растворимого основания в формате 23 задания огэ по химии. 1.Дан раствор гидроксида натрия, а также набор следующих реактивов: оксид меди (II), серная кислота, растворы сульфата натрия, сульфата меди (II), фенолфталеина. Возможно использование индикаторной бумаги.
В рабочем листе записывают уравнения химической реакции в молекулярном виде, описывают добавление фенолфталеина к раствору щелочи и появление малиновой окраски .После добавления кислоты указывают признак реакции-обесцвечивание раствора. 2NaOH + CuSO4→ Na2SO4 +Cu( OH) 2 В рабочем листе записывают уравнения химической реакции в молекулярном виде, указывают признак реакции (выпадение голубого осадка гидроксида меди (II). (5 мин) 2. В данном эксперименте рассмотрены свойства щелочей в реакциях с кислотами и солями, напишите уравнение реакции взаимодействия гидроксида натрия с углекислым газом, с гидроксидом алюминия при сплавлении, в растворе, с оксидом цинка в растворе и при сплавлении. Последние 4 реакции записывают с учителем. 2NaОН + CO2→Na 2CO3 + H2O 2NaОНтв. + ZnO →Na2ZnO2+ H2O 2NaОНр. + ZnO + H2O →Na2[Zn(OH)4] NaОНтв. + Al(OH)3→NaAlO2 + 2H2O NaOH+ Al(OH)3→ Na[Al(OH)4]
Сделайте вывод о химических свойствах гидроксидов щелочных металлов. ВЫВОД: гидроксиды ЩМ способны реагировать с кислотами, кислотными и амфотерными оксидами, солями, амфотерными гидроксидами.(5 мин) 3 этап -заполняют таблицу, пользуясь слайдами презентации и учебником стр. 156-158 п.30 ,выписывают применение гидроксидов и солей Щ.М.
(5 мин)
| Учащиеся делают заключение, что речь пойдет о соединениях Щ.М., их свойствах, применении соединений Щ.М. Называют тему урока, составляют план её изучения.
Учащиеся рассматривают физические свойства оксидов и гидроксидов щелочных металлов, экспериментально доказывают химические свойства соединений Щ.М. Делают выводы на основе опытных данных и теоретического материала. Изучают применение соединений щелочных металлов в быту и промышленности. | Регулятивные УУД: умение ставить учебную задачу, планировать этапы ее решения. Познавательные УУД: развитие и углубление потребностей и мотивов учебно-познавательной деятельности; Личностные УУД: формирование мотивации к обучению и целенаправленной познавательной деятельности; Коммуникативные УУД: формирование умения строить речевое высказывание в соответствии с поставленными задачами.
Познавательные УУД: формирование знаний о свойствах и применении соединений щелочных металлов; совершенствование экспериментальных умений и навыков учащихся. Регулятивные УУД: умение решать учебную задачу согласно инструкции; развитие умений выбирать и анализировать информацию, полученную в результате эксперимента, работы с учебником Коммуникативные УУД: формировать умение планировать работу в группе, логически излагать свои выводы. Личностные УУД: развивать познавательный интерес школьников, используя данные о применении изучаемых явлений в окружающей жизни.
| ||||||||||||||||||||||||||||||||||||||||||
| 5. Первичное закрепление знаний | Учитель предлагает закрепить изученный материал выполнением задания 4 на химические свойства соединений щелочных металлов в рабочих листах по 2 вариантам. Правильность ответов проверяют по слайдам.(5 мин).Приложение 2.
| Учащиеся выполняют задание на закрепление знаний | Познавательные УУД: применение полученных знаний при практическом решении задач Личностные УУД: формирование познавательных интересов и мотивов, направленных на изучение программы | ||||||||||||||||||||||||||||||||||||||||||
| 6. Рефлексия | Учитель акцентирует внимание учащихся на конечных результатах учебной деятельности на уроке: 1. Что нового вы узнали сегодня на уроке? 2. Какие затруднения у вас возникли при работе? 3. Помогло ли вам выполнение лабораторной работы при изучении нового материала? 4. Остались ли вопросы по новой теме (2 мин) | Учащиеся выполняют самоанализ деятельности | Коммуникативные УУД: учатся адекватно анализировать свою деятельность и деятельность товарищей | ||||||||||||||||||||||||||||||||||||||||||
| 7. Домашнее задание | Учитель дает комментарии к домашнему заданию (3 мин)
| Записывают домашнее задание. По необходимости задают уточняющие вопросы |
| ||||||||||||||||||||||||||||||||||||||||||
Приложение 1
Вариант 1.
Задание 1.Выполни тест.
1. Выберите два высказывания, в которых говорится о калии как о химическом элементе.
1) Воспламенившийся калий тушат содой или поваренной солью.
2) Калий используют как катализатор при производстве некоторых видов синтетического каучука.
3) При недостатке калия семена теряют всхожесть.
4) Инертный газ — единственная безопасная для калия среда.
5) Калий содержится в крови и цитоплазме клеток._________________________
2. На рисунке изображена схема распределения электронов по электронным слоям атома некоторого химического элемента.
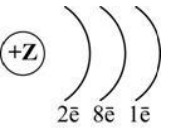
Запишите номер периода (X) и номер группы (Y), в которой данный химический элемент расположен в Периодической системе Д.И. Менделеева. (Для записи ответа используйте арабские цифры.)_____________
3. Расположите химические элементы
1) кальций 2) калий 3) бериллий
в порядке увеличения радиусов их атомов.
Запишите номера элементов в соответствующем порядке.____________________
4. Из предложенного перечня выберите два вещества с металлической связью.
1) СО2
2) ВаCl2
3) Na
4) Li
5) N2O
Запишите номера выбранных ответов._____________________________
5. Какие два утверждения верны для характеристики как углерода, так и натрия?
1) Электроны в атоме расположены на трёх электронных слоях.
2) Соответствующее простое вещество является металлом.
3) Химический элемент образует амфотерный оксид.
4) Значение электроотрицательности меньше, чем у кислорода.
5) Химический элемент образует соединения как с кислородом, так и с водородом.
Запишите номера выбранных ответов.____________________________
Вариант 2.
Задание 1.Выполни тест.
1. Выберите два высказывания, в которых говорится о натрии как о химическом элементе:
1) Натрий — мягкий щелочной металл серебристо-белого цвета
2) Натрий — шестой по распространенности в земной коре
3) Натрий под высоким давлением становится прозрачным и красным, как рубин
4) Натрий содержится в морской воде
5) Натрий широко используется в металлургии_______________________
2.На рисунке изображена модель строения ядра атома некоторого химического элемента.
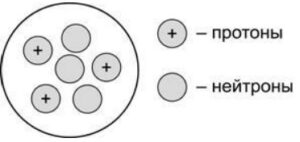
Запишите номер группы (X), в которой данный химический элемент расположен в Периодической системе Д.И. Менделеева, и общее число электронов (Y) в атоме данного элемента. (Для записи ответа используйте арабские цифры.)__________________________________
3. Расположите химические элементы –
1) литий 2) калий 3) натрий
в порядке увеличения металлических свойств образуемых ими простых веществ.
Запишите указанные номера элементов в соответствующем порядке._______________________
4. Из предложенного перечня выберите два вещества с металлической связью.
1) Br2 2) О2
3) Nа 4) K 5) BaO
Запишите номера выбранных ответов.________________________________
5. Какие два утверждения верны для характеристики как натрия, так и калия?
1) На внешнем уровне атом содержит один электрон.
2) Атомный радиус больше атомного радиуса алюминия.
3) Взаимодействует с кислородом, но не взаимодействует с водородом.
4) Образует амфотерный гидроксид.
5) Высший оксид имеет состав ЭО2.
Запишите номера выбранных ответов._____________________________
Приложение 2
Вариант 1.
Задание 4.
1. Выберите один или несколько правильных ответов.
Какие два из перечисленных веществ вступают в реакцию с оксидом натрия?
1) N2 2) SO2
3) KOH 4) H2S 5) NaNO3
Запишите номера выбранных ответов._________________________
2. Установите соответствие между реагирующими веществами и продуктом(-ами) их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na2O и H2O
Б) Na и H2O
В) LiOH и SO3
ПРОДУКТ(Ы) ВЗАИМОДЕЙСТВИЯ
1) NaOH
2) Li2SO4 и H2O
3) NaOH и H2
4) Li2SO4 и H2
5) Li2SO3 и H2O
Запишите в таблицу выбранные цифры под соответствующими буквами. А Б В
____________
3. Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) C
Б) CO2
В) NaOH
РЕАГЕНТЫ
1) KOH, CaO
2) CO2, H2S
3) HNO3, Ca(OH)2
4) O2, Fe2O3
Запишите в таблицу выбранные цифры под соответствующими буквами. А Б В
____________
4. Из предложенного перечня выберите две пары веществ, между которыми протекает реакция обмена.
1) хлорид аммония и нитрат серебра
2) оксид серы(IV) и кислород
3) гидроксид калия и азотная кислота
4) алюминий и гидроксид натрия
5) оксид углерода(IV) и вода
Запишите номера выбранных ответов.____________________
5.Из перечисленных суждений о правилах работы с веществами в лаборатории и быту выберите верное(-ые) суждение(-я).
1) Все газообразные вещества в лаборатории необходимо получать с использованием вытяжного шкафа.
2) При получении кислорода термическим разложением перманганата калия необходимо использовать защитные очки.
3) Все препараты бытовой химии рекомендуется хранить в холодильнике.
4) Выпаривание является методом разделения однородных смесей.
Запишите в поле ответа номер(а) верного(-ых) суждения(-й)._______________________
6. Когда человека мучает изжога, он пользуется раствором питьевой соды. Вычислить массу соды, требуемой для нейтрализации 1,02г соляной кислоты, вызвавшей повышенную кислотность желудка.
Вариант 2
Задание 4.
1. Выберите один или несколько правильных ответов.
Какие два из перечисленных веществ не вступают в реакцию с оксидом калия?
1) N2 2) FeO
3) SO2 4) Al2O3 5) H3PO4
Запишите номера выбранных ответов.___________________________________
2. Установите соответствие между реагирующими веществами и возможным(и) продуктом(-ами) их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe2(SO4)3 и NaOH
Б) P2O5 и NaOH
В) H3PO4 и NaOH
ПРОДУКТ(Ы) ВЗАИМОДЕЙСТВИЯ
1) Fe(OH)2 и Na2SO4
2) Na3PO4 и H2O
3) Na3PO4 и H2
4) Na2SO4 и Fe(OH)3
5) Na2HPO3
Запишите в таблицу выбранные цифры под соответствующими буквами. А Б В
___________
3. Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) NaOH
Б) CO2
В) N2
РЕАГЕНТЫ
1) CaO, KOH
2) HNO3, CuO
3) HBr, SiO2
4) O2, Mg
Запишите в таблицу выбранные цифры под соответствующими буквами. А Б В
__________
4.Из предложенного перечня выберите две пары веществ, взаимодействие между которыми относится к реакциям соединения.
1) хлороводород и гидроксид натрия
2) хлороводород и аммиак
3) соляная кислота и цинк
4) оксид натрия и вода
5) оксид железа(III) и алюминий
Запишите номера выбранных ответов._________________
5. Из перечисленных суждений о правилах безопасного обращения с препаратами бытовой химии выберите верное(-ые) суждение(-я).
1) При приготовлении раствора пищевой соды резиновые перчатки можно не использовать.
2) При опрыскивании садовых растений препаратами, защищающими от насекомых-вредителей, необходимо использовать средства индивидуальной защиты.
3) Все препараты бытовой химии следует хранить в холодильнике.
4) Ремонтные работы с органическими растворителями и красками на их основе должны выполняться в проветриваемом помещении.
Запишите в поле ответа номер(а) верного(-ых) суждения(-й).____________________
6. Когда человека мучает изжога, он пользуется раствором питьевой соды. Вычислить массу соды, требуемой для нейтрализации 1,02г соляной кислоты, вызвавшей повышенную кислотность желудка.
Приложение 3
Составьте схемы, пользуясь учебником стр. 91, о значении ионов натрия и калия для живых организмов (растений и животных). Продукты, содержащие данные ионы.
КАЛИЙ
Калий необходим абсолютно всем растениям, животным и микроорганизмам на Земле. Основная масса калия находится в цитоплазме и вакуолях клеток. Установлено, что в пластидах и ядрах клеток калий отсутствует. Почти 80 % калия находится в клеточном соке и легко вымывается водой, особенно из старых листьев, повышает устойчивость растений к увяданию и преждевременному обезвоживанию и тем самым увеличивает сопротивляемость растений кратковременным засухам. Калий влияет на образование клеточных оболочек, повышает прочность стеблей злаков и их устойчивость к полеганию.
От калия заметно зависит качество урожая. Недостаток его приводит к щуплости семян, понижению их всхожести и жизненности; растения легко поражаются грибными и бактериальными заболеваниями. Калий улучшает форму и вкусовые качества картофеля, повышает содержание сахара в сахарной свекле, влияет не только на окраску и аромат земляники, яблок, персиков, винограда, но и на сочность апельсинов, улучшает качество зерна, листа табака, овощных культур, волокна хлопчатника, льна, конопли. Наибольшее количество калия требуется растениям в период их интенсивного роста.
В животном организме калий находится преимущественно в жидкостях тела и мягких тканях, где является необходимым элементом для поддержания осмотического давления, регуляции реакции крови и тканевой жидкости. Этот минерал регулирует водный баланс и сердечный ритм, наряду с натрием и хлором, принимает участие в энергетическом балансе, способствует выделению солей натрия. Кроме того, калий в организме человека благоприятно воздействует на работу головного мозга, способствуя улучшению процессов снабжения его кислородом. Оптимальная концентрация калия повышает выносливость организма. Нарушение баланса этого элемента, прежде всего, негативно сказывается на функционировании мышц и работе нервной системы. Наибольшее количество данного минерала можно встретить в меде и яблочном уксусе. Затем следуют такие продукты, как: изюм, все виды свежих ягод и зелени, пшеничные отруби, сухофрукты и орехи. Картофель, капуста брюссельская, томаты, морковь, свекла, лук, чеснок и красный перец – растительная пища, которая растет практически в каждом огороде, тоже оказалась богатой на калий. Не отстают и грибы.
Ещё одним кладезем калия являются фрукты: бананы, яблоки, персики, абрикосы, виноград, хурма, апельсины, грейпфрут и мандарины — содержание в этих продуктах колеблется от 400 до 200 мг калия на 100 грамм пищи.
НАТРИЙ
Натрий имеет огромное значение в организме человека. Он активно участвует в функционировании процессов обмена внутри клеток и между ними. Именно этот микроэлемент является главным катионом (то есть ионом, заряженным положительно) внеклеточной жидкости, а значит, нормализует осмотическое давление. Помимо этого натрий отвечает за регуляцию движения воды и возбудимость нервно-мышечных волокон, за нормализацию кислотно-основного состояния. При взаимодействии натрия, калия и хлора создается электролитическая среда, обеспечивающая нервным окончаниям правильное функционирование, что способствует сокращению мышц. Данный микроэлемент обладает способностью удерживать в организме воду, что особенно необходимо для предотвращения обезвоживания. Оптимальное количество натрия ведет к нормализации артериального давления, тогда как его избыток чреват гипертонией.
Натрий участвует в транспортировке полезных веществ через клеточные мембраны, являясь одним из компонентов т.н. натрий-калиевого насоса. Кроме того, он регулирует доставку углеводов в растениях. Отмечено, что при хорошей обеспеченности культур натрием повышается их зимостойкость. Недостаток элемента способствует ухудшению образования хлорофилла.
Натрий в различной концентрации присутствует практически во всех продуктах питания. Однако основными источниками этого макроэлемента являются обычная соль и минеральная вода. Так, например, дневную потребность в натрии можно удовлетворить, употребив вместе с пищей чайную ложку поваренной соли. Наряду с этим, достаточно большое количество Na содержат следующие пищевые продукты:дары моря (морская рыба, водоросли, омары, крабовое мясо, мидии, креветки); бобовые культуры; куриные яйца; молоко.
Инструкция по выполнению задания 24
Внимание: в случае ухудшения самочувствия перед началом опытов
или во время их выполнения обязательно сообщите об этом
организатору в аудитории.
1. Вы приступаете к выполнению задания 24. Для этого получите лоток
с лабораторным оборудованием и реактивами у специалиста по
обеспечению лабораторных работ в аудитории.
2. Прочтите ещё раз перечень веществ, приведённый в тексте к заданиям 23
и 24, и убедитесь (по формулам на этикетках) в том, что на выданном
лотке находится шесть указанных в перечне веществ (или их растворов).
При обнаружении несоответствия набора веществ на лотке перечню
веществ в условии задания сообщите об этом организатору в аудитории.
3. Перед началом выполнения эксперимента осмотрите ёмкости
с реактивами и продумайте способ работы с ними. При этом обратите
внимание на рекомендации, которым Вы должны следовать.
3.1. В склянке находится пипетка. Это означает, что отбор жидкости
и переливание её в пробирку для проведения реакции необходимо
проводить только с помощью пипетки. Для проведения опытов
отбирают 7–10 капель реактива.
3.2. Пипетка в склянке с жидкостью отсутствует. В этом случае
переливание раствора осуществляют через край склянки, которую
располагают так, чтобы при её наклоне этикетка оказалась сверху
(«этикетку – в ладонь!»). Склянку медленно наклоняют над
пробиркой, пока нужный объём раствора не перельётся в неё. Объём
перелитого раствора должен составлять 1–2 мл (1–2 см по высоте
пробирки).
3.3. Для проведения опыта требуется порошкообразное (сыпучее)
вещество. Отбор порошкообразного вещества из ёмкости
осуществляют только с помощью ложечки или шпателя.
3.4. При отборе исходного реактива взят его излишек. Возврат
излишка реактива в исходную ёмкость категорически запрещён. Его
помещают в отдельную, резервную пробирку.
3.5. Сосуд с исходным реактивом (жидкостью или порошком)
обязательно закрывают крышкой (пробкой) от этой же ёмкости.
3.6. При растворении в воде порошкообразного вещества или при
перемешивании реактивов следует слегка ударять пальцем по дну
пробирки.
3.7. Для определения запаха вещества следует взмахом руки над
горлышком сосуда направлять на себя пары этого вещества.
3.8. Если реактив попал на рабочий стол, кожу или одежду,
необходимо незамедлительно обратиться за помощью к специалисту
по обеспечению лабораторных работ в аудитории.
4. Вы готовы к выполнению эксперимента. Поднимите руку
и попросите организатора в аудитории пригласить экспертов для
оценивания проводимого Вами эксперимента.
5. Начинайте выполнять опыт. После проведения каждой реакции или
обоих опытов записывайте в черновик свои наблюдения за изменениями,
происходящими с веществами.
6. Вы завершили эксперимент. Проверьте, соответствуют ли результаты
опытов записям решения задания 23. При необходимости
скорректируйте ответ на задание 23, используя записи в черновике,
которые сделаны при выполнении задания 24.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Соединения щелочных металлов (53.23 KB)
Соединения щелочных металлов (53.23 KB)
 0
0 46
46 0
0 Нравится
0
Нравится
0


