Пояснительная записка
Весь теоретический материал курса химии для основной школы рассматривается на первом году обучения, что позволяет учащимся более осознанно и глубоко изучить фактический материал – химию элементов и их соединений. Наряду с этим такое построение программы дает возможность развивать полученные первоначально теоретические сведения на богатом фактическом материале химии элементов. В результате выигрывают обе составляющие курса: и теория, и практика.
Программа построена с учетом реализации межпредметных связей с курсом физики 7 класса, где изучаются основные сведения о строении молекул и атомов, и биологии 6-9 классов, где дается знакомство с химической организацией клетки и процессами обмена веществ.
Основное содержание курса химии 8 класса составляют сведения о химическом элементе и формах его существования – атомах, изотопах, ионах, простых веществах и важнейших соединениях элемента (оксидах и других бинарных соединениях, кислотах, основаниях и солях), о строении вещества (типологии химических связей и видах кристаллических решеток), некоторых закономерностях протекания реакций и их классификации.
В курсе химии 8 класса предусмотрено : контрольных работ - 4 , практических работ - 6, контрольных тестирований - 3.
Данная программа реализована в учебниках: Габриелян О.С. Химия. 8 класс – М.: Дрофа.2008.
Список литературы для обучающихся и педагогов
Габриеля О.С. Химия. 8 класс – М.: Дрофа, 2008.
Габриелян О.С., Воскобойникова Н.П., Якушева Л.В. Настольная книга учителя. Химия. 8 класс. Методическое пособие. – М.: Дрофа, 2002-2003.
Химия. 8 класс. Контрольные и проверочные работы к учебнику О.С.Габриеляна. О.С.Габриелян, П.Н.Березкин, А.А.Ушаков и др. – М.: Дрофа, 2003-2005.
Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе. Дидактические материалы. – М.: Блик плюс, 2004.
Габриелян О.С., Воскобойникова Н.П. Химия в тестах, задачах, упражнениях. 8 – 9 кл. – М.: Дрофа, 2005.
Аргишева А.И., Задумина Э.А. Химия. Подготовка к ЕГЭ. – С.: Лицей, 2005.
Пилипенко А.Т. Справочник по элементарной химии. – Киев: Наукова думка, 1985.
Требования к уровню подготовки учащихся
Учащиеся должны знать:
определение предмета химии, определение вещества, свойств веществ;
определение физических и химических явлений, признаки химических реакций и условия их возникновения и течения;
правила работы в химическом кабинете;
правила работы с лабораторным оборудованием;
определение атома, простого и сложного вещества;
определение химического элемента, знаки химических элементов, определение относительной атомной и молекулярной массы;
определение валентности;
определение химических уравнений, значение коэффициентов в химических уравнениях;
определение типов химических реакций;
определение количества вещества, моля, числа Авогадро;
определение молярной массы,
определение классов химических соединений, свойства классов веществ.
Учащиеся должны уметь:
описывать вещества по их физическим свойствам;
отличать физические и химические явления;
определять признаки химических реакций, условия их протекания;
обращаться с лабораторным оборудованием;
различать простые и сложные вещества;
отличать понятия химический элемент и простое вещество;
определять валентность по формуле, составлять формулы по валентности;
составлять химические уравнения;
определять типы химических реакций по химическим уравнениям;
определять по формуле число молей по количеству структурных частиц и наоборот;
вычислять по формуле массу данного количества вещества и наоборот;
составлять формулы оксидов, оснований, кислот и солей, давать им названия;
уметь писать диссоциацию веществ;
уметь составлять уравнения ионного обмена (полные и краткие), ОВР;
расставлять коэффициенты в ОВР методом электронного баланса;
определять степень окисления элемента;
приготавливать растворы с определенной массовой долей растворенного вещества;
решать задачи на определение массовой и объемной доли вещества, на нахождение количества вещества по известной массе и наоборот.
Учащиеся могут использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека;
критической оценки информации о веществах, используемых в быту;
приготовления растворов заданной концентрации.
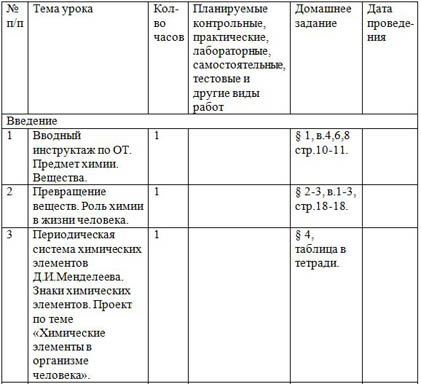
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Рабочая программа по химии (8 класс) (43.05 КB)
Рабочая программа по химии (8 класс) (43.05 КB)
 0
0 543
543 6
6 Нравится
0
Нравится
0



