Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа села Чуваш-Кубово»
муниципального района Иглинский район Республики Башкортостан
Утверждено
директором школы:
Приказ№____
от «__» _________ 2014 г.
«Согласовано»
Заместитель директора
школы по УВР:
_______ / Г.С.Михайлова/
«___» _________ 2014г.
«Согласовано»
Руководитель РМО:
_________ / З.Р.Файрушина/
«___» _________ 2014 г.
Рабочая программа учебного курса
«Химия»
для 9 класса
Составитель: учитель химии и биологии
Закреева Любовь Владимировна
2014-2015 учебный год
Пояснительная записка
Рабочая программа составлена на основе следующих нормативно-правовых документов:
Конституции РФ, ст. 43;
Конвенции о правах ребенка;
Федерального закона от 29 декабря 2012 г. № 273-ФЗ "Об образовании в Российской Федерации";
Приказа № 1089 от 5 марта 2004 "Об утверждении федерального компонента государственных образовательных стандартов начального общего, основного общего и среднего (полного) общего образования" (в соответствии с изменениями);
Приказа от 9 марта 2004 г. N 1312 Об утверждении федерального базисного учебного плана и примерных учебных планов для образовательных учреждений Российской Федерации, реализующих программы общего образования;
Постановления Главного государственного санитарного врача РФ от 29 декабря 2010 № 189 «Об утверждении СанПиН 2.4.2.2821-10 «Санитарно-эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях»;
Закона Республики Башкортостан «Об образовании в Республике Башкортостан» от 1 июля 2013 г. № 696-з;
Концепции развития национального образования в Республике Башкортостан от 31 декабря 2009 г. № УП-730;
Регионального базисного учебного плана и примерных учебных планов для образовательных учреждений Республики Башкортостан, реализующих программы общего образования (Приказ министерства образования РБ №824 от 6 мая 2014г);
10. Нормативной базы по предмету химия ( Новошинский И.И., Новошинская Н.С.)
11. Учебного плана МБОУ СОШ с.Чуваш-Кубово Приказ № 49 от «21» августа 2014 г.
12. Положения о рабочей программе МБОУ СОШ с.Чуваш-Кубово Приказ № 37 от «29» мая 2014г.
Рабочая программа разработана на основе авторской программы курса химии для 8-11 классов общеобразовательных учреждений. Химия. 9 класс», авторы И. И. Новошинский, Н. С. Новошинская (2008 г.), соответствующей Федеральному компоненту государственного стандарта общего образования и допущенной Министерством образования и науки Российской Федерации без изменений. Рабочей программе соответствует учебник: «Химия» 9 класс для общеобразовательных учреждений И.И.Новошинский , Н.С.Новошинская - / 5-е издание, переработанное – М.: ООО «ТИД»Русское слово-РС», 2010.-256с. Программа ориентирована на обучающихся 9 классов(*).
(*)Для обучающихся с отклонениями в развитии осуществляется подбор заданий и изложение материала с учетом их особенностей.
Цели и задачи:
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Общая характеристика учебного предмета
Содержание курса химии 9 класса составляют сведения об окислительно-восстановительных реакциях; Периодическом законе и Периодической системе химических элементов Д.И.Менделеева; скорости химических реакций; строении атомов некоторых химических элементов и свойствах, образованных ими соединений; строении и свойствах органических соединений.
Рабочая программа предусматривает различные формы организации учебного процесса: комбинированные уроки, уроки- семинары, практические и контрольные работы, обобщающие уроки. Предусматривается проведение различных демонстрационных и лабораторных опытов. Для проверки знаний используются различные формы контроля: текущий, промежуточный, итоговый. Для контроля знаний используются разноуровневые тесты с целью подготовки учащихся к ГИА
Место предмета в учебном плане
Уровень программы – общеобразовательный. Учитывая продолжительность учебного года для обучающихся 9 класса на 2014/15 учебный год (33 недели), планирование составлено на 66 ч в год, поэтому в рабочей программе в теме «ОВР» вместо 4 – 3 часов
Объем учебной нагрузки согласно учебного плана школы на 2014/15 учебный год 2 часа в неделю. Количество часов в неделю на изучение предмета согласно программе - 2 часа. Количество часов из регионального базисного учебного плана РБ – 2 часа в неделю.
Рабочая программа по химии построена на основе концентрического подхода. Это достигается путем вычленения укрупненной дидактической единицы. В программе учитывается реализация межпредметных связей с курсом физики и биологии, где дается знакомство с химической организацией клетки и процессами обмена веществ. Количество часов на каждую тему определено в соответствии с контингентом обучающихся данного класса
Ценностные ориентиры содержания учебного предмета
Ценностные ориентиры содержания курса химии в основной школе определяются спецификой химии как науки. Понятие ≪ценности≫ включает единство объективного (сам объект) и субъективного (отношение субъекта к объекту), поэтому в качестве ценностных ориентиров химического образования выступают объекты, изучаемые в курсе химии, к которым у
обучающихся формируется ценностное отношение. При этом ведущую роль играют познавательные ценности, так как данный учебный предмет входит в группу предметов познавательного цикла, главная цель которых заключается в изучении природы.
Основу познавательных ценностей составляют научные знания, научные методы познания, а ценностные ориентации, формируемые у обучающихся в процессе изучения химии, проявляются:
• в признании ценности научного знания, его практической
значимости, достоверности;
•в ценности химических методов исследования живой и
неживой природы;
• в понимании сложности и противоречивости самого процесса познания как извечного стремления к Истине.
В качестве объектов ценностей труда и быта выступают творческая созидательная деятельность, здоровый образ жизни, а ценностные ориентации содержания курса химии могут рассматриваться как формирование:
•уважительного отношения к созидательной, творческой
деятельности;
• понимания необходимости здорового образа жизни;
•потребности в безусловном выполнении правил безопасного использования веществ в повседневной жизни;
• сознательного выбора будущей профессиональной деятельности.
Требования к уровню подготовки обучающихся
В результате изучения химии ученик должен уметь:
Знать/понимать
Уметь
Называть химические элементы,соединения изученных классов
объяснять физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в Периодической системе Д.И.Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена;
характеризовать химические элементы (от водорода до кальция) на основе их положения в Периодической системе химических элементов Д.И.Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
определять состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
составлять формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов Периодической системы Д.И.Менделеева; уравнения химических реакций;
обращаться с химической посудой и лабораторным оборудованием;
распознавать опытным путем вещества
вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции, тепловой эффект реакции;
устанавливать простейшую формулу вещества
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для
безопасного обращения с веществами
экологически грамотного поведения в окружающей среде
оценки влияния химического загрязнения окружающей среды на организм человека
критической оценки информации о веществах, используемых в быту
приготовления растворов заданной концентрации
Содержание учебного предмета
Повторение некоторых вопросов курса химии 8 класса
Реакции ионного обмена. Уравнения реакций в молекулярной и ионной форме. Краткое, полное ионное уравнение.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции. Степень окисления. Нахождение степени окисления элементов в химических соединениях.
Восстановители и окислители, окислительно-восстановительная двойственность. Окисление, восстановление.
Составление уравнений окислительно-восстановительных реакций
Периодический закон и Периодическая система химических элементов Д.И.Менделеева – основа изучения и предсказания свойств элементов и их соединений.
Периодический закон.
Формулировка и смысл Периодического закона. Открытие ПЗ. Физический смысл порядкового №, № периода группы. Закономерности изменения свойств элементов в группе и периоде.
Характеристика положения Эл в ПСХЭ, особенности строения их атомов, сравнение свойств простых веществ, состав оксидов и гидроксидов. Генетические ряды.
Значение Периодического закона.
Водород и его важнейшие соединения
Водород, его общая характеристика, нахождение в природе и получение .
Строение атома водорода, степени окисления. Водород - простое вещество. Водород в природе. Химические свойства водорода, его применение.
Молярный объем газов. Относительная плотность газов.
Вода – кислородосодержащее соединение водорода. Свойства воды.
Решение расчетных задач на нахождение объема реагирующих веществ по уравнению реакции.
Галогены
Строение атомов галогенов, степени окисления.
Галогены - простые вещества. Закономерности изменения физических и химических свойств галогенов в ПСХЭ.
Хлороводород и соляная кислота. Хлориды, бромиды, иодиды.
Качественные реакции на иод.
Качественные реакции на галогениды.
Скорость химических реакций
Химические реакции. Признаки химических реакций.
Классификация химических реакций.
Скорость химических реакций. Факторы, влияющие на скорость химической реакции.
Подгруппа кислорода
Общая характеристика подгруппы кислорода. Аллотропия. Кислород и озон. Состав воздуха.
Сера. Строение атома серы. Аллотропия. Физические и химические свойства серы.
Сероводород, сульфиды, оксиды серы (IV) и (VI).
Кислотные свойства оксидов. Сернистая кислота и ее соли.
Характеристика состава и свойств серной кислоты в свете ОВР и ТЭД.
Сравнение свойств концентрированной и разбавленной кислот.
Сульфаты. Применение в н/х.
Характеристика химических свойств соединений серы.
Подгруппа азота
Строение атомов и молекулы азота.
Физические и химические свойства азота в свете ОВР.
Строение молекулы аммиака. Физические свойства, получение, собирание, распознавание.
Химические свойства: восстановительные и образование иона аммония по донорно-акцепторному механизму.
Соли аммония: состав, получение, физические и химические свойства. Представители, применение в н/х. Распознавание солей аммония.
Получение аммиака, изучение его свойств.
Состав и свойств оксидов азота и соответствующих им кислот.
Физические и химические свойства азотной кислоты. Нитраты и нитриты: разложение при нагревании.
Строение атома. Аллотропия. Сравнение свойств красного и белого фосфора. Химические свойства фосфора. Биологическое значение.
Оксид фосфора (V), фосфорная кислота. Фосфаты.
Качественные реакции на фосфорную кислоту и ее соли. Фосфор в природе.
Распознавание минеральных удобрений. Классификация минеральных удобрений.
Качественная реакция на ионы аммония со щелочью.
Подгруппа углерода
Строение атома. Аллотропия. Адсорбция и ее практическое значение. Химические свойства углерода. Оксиды углерода. Физические и химические свойства, получение и применение.
Строение атома, сравнение его свойств с углеродом.
Кристаллический кремний. Природные соединения кремния.
Силикаты. Кремниевая кислота.
Применение стекла, цемента, фарфора и их производства.
Решение расчетных задач на вычисление массовой и объемной доли выхода и примеси.
Металлы
Значение металлов в жизни человека, в истории цивилизации.
Характеристика положения металла в ПСХЭ.
Особенности строения атомов. Относительность деления элементов на металлы и неметаллы. Металлическая химическая связь.
Металлические кристаллические решетки.
Физические свойства металлов: электро- и теплопроводность, металлический блеск, плотность, твердость. Классификация металлов. Сплавы.
Взаимодействие с кислородом, неметаллами, водой, особенности взаимодействия с кислотами и солями.
Строение атома алюминия и сравнение его с бором. Физические и химические свойства простого вещества. Амфотерный характер соединений.
Магний и кальций.
Сравнительная характеристика строения атомов, физических и химических свойств: взаимодействие с кислородом, серой, водой. Оксиды кальция и магния, гидроксид кальция, соли кальция их значение в жизнедеятельности человека.
Жесткость воды. Классификация. Временная, постоянная жесткость. Меры по ее устранению.
Строение атомов, простые вещества. Химические свойства: взаимодействие с кислородом, неметаллами, водой. Оксиды, гидроксиды, соли: состав и свойства. Важнейшие представители и их использование человеком: питьевая сода, глауберова соль, поташ, поваренная соль. Биологическая роль натрия и калия.
Строение атома железа как элемента побочной подгруппы. Степени окисления железа. Физические и химические свойства простого вещества. Характеристика химических свойств оксидов и гидроксидов железа (II) и(III). Качественные реакции на ионы железа.
Органические вещества
Взаимосвязь неорганических и органических веществ. Особенности органических веществ.
Предельные углеводороды — алканы. Общая характеристика предельных углеводородов. Нахождение в природе, физические и химические свойства: горение, реакция замещения (на примере метана). Применение алканов.
Непредельные углеводороды — алкены. Состав и физические свойства алкенов. Химические свойства: горение, реакции присоединения водорода, галогенов и полимеризации (на примере этилена). Представление о полимерах. Применение этилена в быту и народном хозяйстве.
Природные источники углеводородов. Природные и попутные нефтяные газы, их состав и использование. Нефть. Каменный уголь.
Функциональные группы (гидроксильная, карбоксильная группы, аминогруппа).
Спирты. Общая характеристика спиртов. Метиловый и этиловый спирты. Химические свойства спиртов: горение, взаимодействие с кислотами. Действие спиртов на организм. Трехатомный спирт глицерин. Применение спиртов.
Карбоновые кислоты на примере уксусной кислоты. Ее свойства и применение. Реакция этерификации. Понятие о сложных эфирах.
Жиры — сложные эфиры глицерина и высших карбоновых кислот. Физические свойства, применение и биологическая роль жиров.
Понятие об углеводах. Глюкоза, сахароза, крахмал, целлюлоза, их нахождение в природе и биологическая роль.
Азотсодержащие соединения. Понятие об аминокислотах. Белки, их биологическая роль. Качественные реакции на белки.
Критерии оценивания знаний обучающихся
1.Оценка устного ответа
Отметка «5» :
- ответ полный и правильный на основании изученных теорий;
- материал изложен в определенной логической последовательности, литературным языком;
- ответ самостоятельный.
Ответ «4» ;
- ответ полный и правильный на сновании изученных теорий;
- материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «З» :
- ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2» :
- при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя, отсутствие ответа.
2. Оценка экспериментальных умений.
- Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу. Отметка «5»:
- работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
и порядок (на столе, экономно используются реактивы).
Отметка «4» :
- работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
- работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
- допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники без опасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя;
- работа не выполнена, у учащегося отсутствует экспериментальные умения.
3. Оценка умений решать расчетные задачи.
Отметка «5»:
- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:
- в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:
- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
- имеется существенные ошибки в логическом рассуждении и в решении.
- отсутствие ответа на задание.
4. Оценка письменных контрольных работ.
Отметка «5»:
- ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
- ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
- работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные.
Отметка «2»:
- работа выполнена меньше чем наполовину или содержит несколько существенных ошибок.
- работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
5. Оценка тестовых работ.
Тесты, состоящие из пяти вопросов можно использовать после изучения каждого материала (урока). Тест из 10—15 вопросов используется для периодического контроля. Тест из 20—30 вопросов необходимо использовать для итогового контроля.
При оценивании используется следующая шкала: для теста из пяти вопросов
• нет ошибок — оценка «5»;
• одна ошибка - оценка «4»;
• две ошибки — оценка «З»;
• три ошибки — оценка «2».
Для теста из 30 вопросов:
• 25—З0 правильных ответов — оценка «5»;
• 19—24 правильных ответов — оценка «4»;
• 13—18 правильных ответов — оценка «З»;
• меньше 12 правильных ответов — оценка «2».
График проведения контрольных и практических работ
| № п/п | Наименование темы | Всего часов | Из них
|
| Практические работы | Дата
| Контрольные работы | Дата |
| 1. | Повторение основных вопросов курса 8 класса. | 2
| №1Решение экспериментальных задач по темам: «Важнейшие классы неорганических соединений» и «Реакции ионного обмена» |
|
|
|
| 2. | ОВР | 3
|
|
| | |
| 3. | Периодический закон и Периодическая система химических элементовД.И.Менделеева | 4
| |
|
|
|
| 4. | Водород и его важнейшие соединения | 7
|
|
| №1 по темам: «ОВР», «Периодическая система», «Водород» |
|
| 5. | Галогены | 5
| №2 Галогены
|
| |
|
| 6. | Скорость химических реакций и их классификация | 2
|
|
| |
|
| 7. | Подгруппа кислорода
| 8
| №3 Решение эксперименталь - ных задач по теме «Подгруппа кислорода»
|
| №2 по темам: «Галогены», «Скорость химических реакций», «Подгруппа кислорода»
|
|
| 8. | Подгруппа азота
| 8
| №4 Получение аммиака и изучение его свойств. Соли аммония
|
|
|
|
| 9. | Подгруппа углерода
| 6
| №5Получение оксида углерода (IV) и изучение его свойств. Свойства карбонатов |
| №3 по темам «Подгруппа азота», «Подгруппа углерода»
|
|
| 10. | Металлы и их соединения
| 11
| №6 Решение эксперименталь-ных задач по теме «Металлы и их соединения» |
| №4 по теме «Металлы и их соединения»
|
|
| 11. | Органические соединения | 10
|
|
|
|
|
|
|
| 66 | 6 |
| 4 |
|
При оформлении рабочей программы были использованы следующие условные обозначения:
для классификации типов уроков:
урок изучения нового материала (УИНМ);
комбинированный урок (КУ);
урок применения знаний и умений (УПЗУ);
урок контроля знаний (УКЗ)
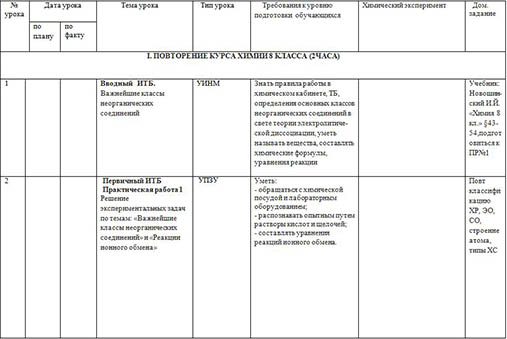
КАЛЕНДАРНО-ТЕМАТИЧЕСОЕ ПЛАНИРОВАНИЕ
| № урока
| Дата урока | Тема урока
| Тип урока
| Требования к уровню подготовки обучающихся
| Химический эксперимент
| Дом. задание
|
| по плану | по факту |
| I. ПОВТОРЕНИЕ КУРСА ХИМИИ 8 КЛАССА (2ЧАСА) |
| 1 |
|
| Вводный ИТБ. Важнейшие классы неорганических соединений | УИНМ | Знать правила работы в химическом кабинете, ТБ, определения основных классов неорганических соединений в свете теории электролитической диссоциации, уметь называть вещества, составлять химические формулы, уравнения реакции |
| Учебник: Новошин- ский И.Й. «Химия 8 кл.» §43-54,подготовиться к ПР№1 |
| 2 |
|
| Первичный ИТБ Практическая работа 1 Решение экспериментальных задач по темам: «Важнейшие классы неорганических соединений» и «Реакции ионного обмена» | УПЗУ
| Уметь: - обращаться с химической посудой и лабораторным оборудованием; - распознавать опытным путем растворы кислот и щелочей; - составлять уравнения реакций ионного обмена.
|
| Повт классификацию ХР, ЭО, СО, строение атома, типы ХС |
| II. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (3 ЧАСА)
|
| 3 |
|
| Понятие об окислительно-восстановительных реакциях | УИНМ
| Знать понятия «окислитель», «восстановитель», «окисление» и «восстановление». | Д Сравнение взаимодействия HCl c Zn и взаимодействия HCl c CaO Д Сравнение горения серы (угля) и взаимодействия СО2 с NaOH | § 1, №1,2 |
| 4 |
|
| Окислители и восстановители. Окислительно-восстановительная двойственность
| УИНМ | Уметь определять окислительно-восстановительные свойства вещества по максимальной, промежуточной, миниальной степеням окисления |
| §2, № 1,2 |
| 5 |
|
| Составление уравнений окислительно- восстановительных реакций | УПЗУ
| Уметь составлять уравнения окислительновосстановительных реакций методом электронного баланса ; анализировать окислительно-восстановительный процесс, определять окислитель и восстановитель, расставлять коэффициенты в уравнениях ОВР
| Л 1 Окислительно-восстановительные реакции | § 3, №1
|
| III. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА (4 ЧАСА) |
| 6
|
|
| Периодический закон
| УИНМ
| Знать предпосылки открытия Периодического закона, современную формулировку; причины периодичности свойств атомов элементов и их соединений; представления о Периодическом законе и Периодической системе в свете теории строения атома
| Д ПСХЭ Д Опыты по сопоставлению металлических и неметаллических свойств простых веществ; кислотно-основных свойств оксидов и гидроксидов Л2 Сущность явления перио-дичности(отношение Mg(OH)2 и Ca(OH)2 к растворам HCl и NaOH)
| §4, № 1-3
|
| 7 |
|
| Характеристика химического элемента и его соединений на основе положения в Периоди- ческой системе и строения атома | УПЗУ | Знать предпосылки открытия Периодического закона, современную формулировку; причины периодичности свойств атомов элементов и их соединений; представления о Периодическом законе и Периодической системе в свете теории строения атома
|
| §5 |
| 8 |
|
| Значение Периодического закона | УПЗУ
| Знать значение Периодического закона для науки, уметь характеризовать химический элемент по плану характеристики
|
| §6
|
| 9 |
|
| Итоговый урок по темам: «ОВР» и «Периодический закон и Периодическая система химических элементов Д.И.Менделеева-основа изучения и предсказания свойств элементов и их соединений»
| УПЗУ | Знать понятия об ОВР, строение атома, уметь составлять ОВР, характеризовать химический элемент на основе строения его атома
|
| Повто-рить основные понятия темы |
| IV. ВОДОРОД И ЕГО ВАЖНЕЙШИЕ СОЕДИНЕНИЯ (7 ЧАСОВ)
|
| 10
|
|
| Водород
| КУ | Знать положение водорода в Периодической системе, уметь называть: хим.элемент по символам; формулу молекулы водорода, знать нахождение в природе, получение |
| §7, №1-4
|
| 11 |
|
| Свойства и применение водорода | УИНМ | Знать физические свойства водорода, уметь характеризовать химические свойства водорода; составлять реакции восстановления металлов из их оксидов водородом |
| § 8, №1-6 |
| 12 |
|
| Молярный объем газов. Относительная плотность газов | УИНМ | Знать определения молярного объема газов, газообразного состояния вещества, уметь рассчитывать относительную плотность газов, молярный объем газов |
| § 9 № 1, 2, §10, № 1-3
|
| 13 |
|
| Вычисления по уравнениям химических реакций с использованием физической величины «молярный объём газа» | УПЗУ | Уметь производить расчеты по химическим уравнениям объемов газов |
| §11, № 1,2, 4 |
| 14 |
|
| Оксид водорода - вода | КУ | Уметь характеризовать количественный и качественный состав воды; описывать физические и химические свойства воды; способы очистки воды от примесей; экологические проблемы, связанные с очисткой воды; меры по охране воды от загрязнений
| Д Получение водорода и ознакомление с его физическими и химическими свойствами Д Модель молекулы воды Д Очистка воды перегонкой Д Взаимодействие воды с натрием, оксидом фосфора (Y) и оксидом кальция, испытание полученных растворов гидроксидов индикаторами
| § 12, № 2,3,7,8 |
| 15 |
|
| Систематизация и обобщение изученного материала
| УПЗУ | Знать характеристику водорода как химического элемента, так и простого вещества, Соединения водорода, уметь выполнять расчетные задачи на вычисление молярного объема газов |
| Подгот. к контрольной работе №1 по темам: «ОВР», «Периодическая система», «Водород» |
| 16 |
|
| Контрольная работа № 1 по темам: «ОВР», «Периодическая система», «Водород» | УКЗ |
|
|
|
| V. ГАЛОГЕНЫ (5ЧАСОВ)
|
| 17
18
|
|
| Общая характеристика галогенов
Хлор | УИНМ
УИНМ | Знать характеристику галогенов на основе положения их в Периодической системе, физические и химические свойства, уметь сравнивать строение атомов, свойства простых веществ, составлять уравнения химических реакций
Знать свойства хлора, его применение и действие на организм, уметь характеризовать хлор по плану характеристики химического элемента и простого вещества, уметь применять знания по оказанию первой медицинской помощи при отравлении хлором | Д Образцы галогенов Л 3 Вытеснение одних галогенов другими из их соединений (галогенидов) Л 4 Растворимость брома и иода в органических растворителях.
Д Получение хлорной воды. Д Обесцвечивание хлорной водой красящих веществ
| §13, №1-3
§ 14, № 1-5
|
| 19
|
|
| Хлороводород и соляная кислота | КУ | Знать основные способы получения хлороводоро- да и соляной кислоты, свойства соляной кислоты, знать области применения соляной кислоты, качественные реакции на галогениды, уметь составлять уравнения химических реакций взаимодействия соляной кислоты с металлами, оксидами металлов, основаниями и солями | Д Получение хлороводорода и соляной кислоты Д Качественная реакция на хлорид-ион | § 15, №1-5 |
| 20 |
|
| Фтор. Бром. Иод. | УИНМ | Знать свойства фтора, брома, иода; качественны реакции на иод, фторид- и иодид- ионы.
| Л 5 Распознавание иода Л 6 Распознавание хлорид-, бромид-, иодид-ионов в растворах
| § 16, №1-4; подгото- виться к ПР№2
|
| 21 |
|
| Текущий ИТБ Практическая работа 2 Галогены | УПЗУ | Уметь проводить опыты, соблюдая ТБ при обращении с хим. посудой и реактивами |
|
|
| VI. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ИХ КЛАССИФИКАЦИЯ(2 ЧАСА) |
| 22 |
|
| Понятие о скорости химических реакций | КУ | Знать определение скорости химической реакции; единицы измерения;понятие о гомогенных и гетерогенных реакциях; зависимость скорости хим. реакции от различных факторов
| Д Взаимодействие цинка с уксусной и соляной кислотами Д Разложение пероксида водорода в присутствии оксида марганца (IV) Д Взаимодействие оксида меди (II) с серной кислотой различной концентрации и при разных температурах Л 7 Влияние площади поверхности твердого вещества на скорость растворения мела в соляной кислоте | §18, №1-4 |
| 23 |
|
| Классификация химических реакций | УПЗУ | Знать понятие об обратимых и необратимых химических реакциях, типах химических реакций, уметь определять тип реакции по уравнению, составлять уравнения химических реакций
|
| §19, № 1-4 |
| VII. ПОДГРУППА КИСЛОРОДА (8 ЧАСОВ)
|
| 24 |
|
| Кислород | КУ | Знать: - способы получения кислорода; - значение кислорода в атмосфере и в жизнедеятельности человека. Уметь записывать уравнения химических реакций кислорода с простыми и сложными веществами | Д Получение кислорода и ознакомление с его физическими и химическими свойствами | § 20, № 1-4 |
| 25 |
|
| Озон. Аллотропия | УИНМ | Знать понятие «аллотропия», физико – химические свойства озона
|
| § 21, № 1-4 |
| 26 |
|
| Сера | КУ | Знать аллотропные видоизменения серы; Уметь: -характеризовать химический элемент по положению в Периодической системе химических элементов Д.И.Менделеева и строения атома; - записывать уравнения химических реакций | Д Образцы серы и ее природных соединений Д Взаимодействие серы с металлами и кислородом | § 22 № 1-3 |
| 27 |
|
| Сероводород. Оксид серы(IV). Сернистая кислота
| КУ | Знать: - физико – химические свойства сероводорода; оксида серы(IV);сернистой кислоты; - качественную реакцию на сульфид и сульфит – ионы Уметь записывать уравнения реакций в ионном виде и с точки зрения окислительно – восстановительных реакций | Д Распознавание сульфид- и сульфит-ионов в растворе | § 23, № 1-3, § 24, № 1-3
|
| 28
|
|
| Оксид серы(VI).Серная кислота
| УИНМ | Знать: - физико – химические свойства оксида серы (VI) и серной кислоты ; - качественную реакцию на сульфат – ион. Уметь записывать уравнения реакций в ионном виде и с точки зрения окислительно – восстановительных реакций.
| Д Взаимодействие конц. серной кислоты с сахаром Л 8 Качественная реакция на сульфат-ион | § 25, № 1- 4; подгото- виться к ПР№3
|
| 29 |
|
| Текущий ИТБ. Практическая работа 3 Решение эксперименталь - ных задач по теме «Подгруппа кислорода»
| УПЗУ | Уметь: - обращаться с химической посудой и лабораторным оборудованием; - распознавать опытным путем сульфид, сульфит, сульфат ионы |
|
|
| 30
|
|
| Итоговый урок по темам: «Галогены», « Скорость химических реакции», «Подгруппа кислорода»
| УПЗУ |
|
| Подгот.к конроль- ной работе №2 по темам: «Галоге- ны», «Скоро- сть химических реакции», «Подгру-ппа кислоро- да»
|
| 31
|
|
| Контрольная работа № 2 по темам: «Галогены», «Скорость химических реакций», «Подгруппа кислорода»
| УКЗ |
|
|
|
| VIII. ПОДГРУППА АЗОТА (8 ЧАСОВ) |
| 32 |
|
| Азот | УИНМ | Знать положение азота в Периодической системе, физические и химические свойства, нахождение в природе, применение, уметь характеризовать азот как химический элемент, так и азот как простое вещество, определять степень окисления азота в соединениях, составлять уравнения химических реакций |
| §27, № 1-4 |
| 33 |
|
| Аммиак. Соли аммония | КУ | Знать получение, свойства и применение изучаемых соединений. Уметь распознавать соли аммония в растворе | Л 9 Качественная реакция на соли аммония Д Растворение аммиака в воде Д Горение аммиака в кислороде Д Взаимодействие аммиака с хлороводородом | §28, № 1-5; подгото- виться к ПР№4
|
| 34 |
|
| Текущий ИТБ. Практическая работа 4 Получение аммиака и изучение его свойств. Соли аммония
| УПЗУ | Уметь проводить опыты, соблюдая ТБ при обращении с хим. посудой и реактивами ;получать и собирать аммиак и распознавать его опытным путем |
|
|
| 35
|
|
| Оксиды азота
| УИНМ | Уметь составлять формулы, составлять уравнения реакций, лежащих в основе промышленного и лабораторного способов получения оксидов азота |
| § 29, № 1,2,4 |
| 36
|
|
| Азотная кислота
| УИНМ
| Знать получение, свойства и применение азотной кислоты и ее солей, окислительные свойства азотной кислоты
| Д Взаимодействие концентрированной азотной кислоты с медью
| § 30, № 1- 5 |
| 37 |
|
| Фосфор и его соединения
| УИНМ | Знать: - строение атома, аллотропные видоизменения, свойства и применение фосфора; - качественную реакцию на фосфат ионы; Уметь писать уравнения реакций образования фосфидов, фосфина, оксида фосфора (V), свойств фосфорной кислоты, распознавать фосфат ионы | Л 10 Качественная реакция на фосфат-ион | § 32, № 1-5 (до«Кру- говорота фосфора в природе
|
| 38
|
|
| Круговорот азота и фосфора в природе
| КУ | Знать состав и условия рационального хранения и применения минеральных удобрений | Д Образцы азотных и фосфорных удобрений | § 31, № 1, 2; § 32(с.143 «Круго- ворота фосфора в приро- де»)
|
| 39 |
|
| Контрольно-обобщающий урок по теме «Подгруппа азота» | УПЗУ | Знать физико – химические свойства соединений азота;качественную реакцию на нитрат и фосфат ионы. Уметь записывать уравнения реакций в ионном виде и с точки зрения окислительно – восстановительных реакций. |
| Повт § 27-32
|
| IX. ПОДГРУППА УГЛЕРОДА (6 ЧАСОВ) |
| 40 |
|
| Углерод
| УИНМ | Знать строение атома; аллотропные видоизменения; свойства и применение углерода | Л 11 Адсорбционные свойства углерода Д Образцы природных соединений углерода Д Кристаллические решетки алмаза и графита | § 33, №1-4
|
| 41 |
|
| Кислородные соединения углерода
| КУ | Знать качественные реакции на углекислый газ и карбонаты. Уметь писать уравнения реакций, отражающие свойства оксидов углерода. Знать физиологическое действие на организм человека угарного газа. Уметь оказывать первую медицинскую помощь при отравлении | Д Отношение карбонатов и гидрокарбонатов к действию кислот Л 12 Распознавание карбонатов | § 34, №1-4, подгото- виться к ПР№5
|
| 42 |
|
| ТекущийИТБ. Практическая работа 5 Получение оксида углерода (IV) и изучение его свойств. Свойства карбонатов | УПЗУ | Уметь обращаться с химической посудой и лабораторным оборудованием; получать, собирать и распознавать опытным путем оксид углерода (IV) |
|
|
| 43 |
|
| Кремний и его соединения | УИНМ | Знать свойства, аллотпропные видоизменения, значение соединений кремния в живой и неживой природе | Д Образцы природных соединений кремния Д Получение кремниевой кислоты | § 36, № 1-6
|
| 44 |
|
| Итоговый урок. Систематизация и обобщение знаний по темам: «Подгруппа азота» и «Подгруппа углеро- да»
| УПЗУ | Уметь давать общую характеристику элементов подгруппы, записывать уравнения реакций, отражающих способы получения и хим. свойства, распознавать ионы, решать расчетные задачи |
| Повт. § 27-36, Подгот.к конроль- ной работе №3 по темам: «Подгруппа азота» и «Подгруппа углеро- да»
|
| 45 |
|
| Контрольная работа № 3 по темам «Подгруппа азота», «Подгруппа углерода»
| УКЗ |
|
|
|
| X. МЕТАЛЛЫ И ИХ СОЕДИНЕНИЯ (11 ЧАСОВ) |
| 46 |
|
| Общая характеристика металлов. Получение и физические свойства металлов | УИНМ | Знать характеристику металлов, положение их в Периодической системе, нахождение в природе, физические свойства; способы получения металлов. Уметь объяснять причину общих свойств металлов | Д Образцы минералов и металлов | § 38, № 1- 5
|
| 47 |
|
| Химические свойства металлов
| КУ | Знать общие свойства металлов: взаимодействие с неметаллами, водой, кислотами, солями; Уметь записывать уравнения реакций взаимодействия с неметаллами, кислотами, солями, используя электрохимический ряд напряжений металлов для характеристики химических свойств | Д Опыты, показывающие восстановительные свойства металлов | § 39, № 1 - 6
|
| 48 |
|
| Алюминий и его соединения
| КУ | Знать химические свойства алюминия Уметь характеризовать химический элемент алюминий по положению в Периодической системе химических элементов Д.И.Менделеева и строению атома | Л 14 Получение гидроксида алюминия и исследование его кислотно-основных свойств | § 41, № 1-5
|
| 49 |
|
| Магний и кальций | КУ | Знать физическйе и химические свойства магния и кальция, их соединений, биологическую роль и применение соединений кальция и магния, уметь характеризовать магний и кальций по положению в Периодической системе,строению атомов, составлять уравнения химических реакций | Д Взаимодействие кальция с водой Д Окрашивание пламени ионами кальция Д Качественная реакция на ионы кальция | § 42, № 1-5
|
| 50 |
|
| Жесткость воды и способы ее устранения | КУ | Знать виды жесткости, способы устранения, уметь составлять уравнения реакций | Л 15 Жесткость воды и ее устранение | §43, № 1-5
|
| 51 |
|
| Щелочные металлы | УИНМ | Знать получение, свойства и применение щелочных металлов. Уметь распознавать ионы щелочных металлов
| Д Взаимодействие натрия с водой. Д Окрашивание пламени ионами натрия и калия. Д Образцы калийных удобрений | §44, № 1-3
|
| 52 |
|
| Железо | УИНМ | Уметь составлять схему строения атома; записывать уравнения реакций химических свойств железа с образованием соединений с различными степенями окисления железа | Д Взаимодействие железа с растворами кислот и солей | § 45, № 1-5 |
| 53 |
|
| Соединения и сплавы железа | КУ | Знать химические свойства соединений железа (II)и (III); Уметь: - осуществлять цепочки превращений; - определять соединения, содержащие ионы Fe2+ и Fe3+ с помощью качественных реакций
| Л 16 Качественные реакции на двух- и трехзарядные ионы железа Д Получение и исследование свойств гидроксидов железа (II) и (III)
| § 46, №1-3, подгото- виться к ПР№6
|
| 54 |
|
| Текущий ИТБ. Практическая работа 6 Решение эксперименталь-ных задач по теме «Металлы и их соединения» | УПЗУ | Уметь обращаться с химической посудой и лабораторным оборудованием; распознавать опытным путем соединения металлов |
|
|
| 55
|
|
| Итоговый урок. Систематизация и обобщение знаний по теме «Металлы и их соединения»
| УПЗУ | Знать положение металлов в Периодической таблице, физические и химические свойства щелочных металлов, алюминия, железа, уметь составлять уравнения химических реакций
|
| Повт § 38-46 Подгот.к конроль- ной работе №4 по те- ме «Металлы и их соедине- ния» |
| 56 |
|
| Контрольная работа № 4 по теме «Металлы и их соединения» | УКЗ |
|
|
|
| XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ (10 ЧАСОВ) |
| 57 |
|
| Первоначальные представления об органических соединениях | УИНМ | Знать особенности органических веществ, уметь сравнивать неорганические и органические вещества, объяснять многообразие органических веществ | Д Образцы органических веществ, изделия из них | § 48, № 1,2 |
| 58 |
|
| Углеводороды.Предельные углеводороды-алканы
| УИНМ | Знать определение предельных углеводородов, физические и химиче- ские свойства на примере метана, практическое значение, уметь составлять формулы предельных углеводородов, составлять реакции замещения, горения | Д Отношение метана к кислороду и бромной воде | § 49, № 1-3
|
| 59 |
|
| Непредельные углеводороды-алкены
| УИНМ | Знать определение непредельных углеводородов, их отличие от предельных углеводородов, физические и химические свойства, уметь составлять реакции горения, присоединения, полимеризации | Д Отношение этилена к кислороду и бромной воде
Д Образцы полимеров | § 50, № 1-4
|
| 60 |
|
| Природные источники углеводородов
| КУ | Знать основные источники углеводородов в природе, применение, использование в народном хозяйстве, уметь оценивать состояние запасов полезных ископаемых, эффективность различных видов топлива | Д
образцов нефти и продуктов ее переработки | § 51, № 1-3 |
| 61 |
|
| Кислородсодержащие органические соединения. Спирты | КУ | Знать состав, номенклатуру и свойства спиртов. Иметь представление о многоатомных спиртах | Д Горение спиртов | § 52, № 1-2 |
| 62 |
|
| Уксусная кислота
| КУ | Знать вещества, относящиеся к карбоновым кислотам, их физические и химические свойства на примере уксусной кислоты, применение кислот в быту | Л 17 Свойства уксусной кислоты | § 53, № 1-3 |
| 63 |
|
| Жиры
| КУ | Знать понятие о жирах, физические свойства жиров, их применение и биологическую роль | Д Образцы жиров | § 54, № 1,2 |
| 64 |
|
| Углеводы
| КУ | Знать вещества, относящиеся к классу углеводов, нахождение глюкозы, сахарозы в природе, биологическую роль этих веществ | Д Образцы углеводов | § 55, № 1,3,4 |
| 65 |
|
| Азотосодержащие органические соединения\
| КУ | Знать о биологической роли белков, аминокислот, качественные реакции на белки | Л 17 Качественная реакция на белки | § 56, № 1-4 |
| 66 |
|
| Контрольно-обобщающий урок по тем«Органические соединения»
| УПЗУ | Уметь классифицировать органические вещества; Иметь первоначальные сведения о химических свойствах органических соединений |
|
|
Материально-техническое обеспечение.
Учебно-методический комплект
1.Примерная программа основного общего образования по химии (базовый уровень);
2.Авторская программа Новошинского Н.Н. для курса химии 8-11 классов общеобразовательных учреждений (2008г )соответствующей
Федеральному компоненту государственного стандарта общего образования и допущенной Министерством образования и науки Российской
Федерации без изменений-3-е изд.-е,Сост.в.е.Морозов;изд.М: «Планета»,2012
3. Новошинский И.И., Новошинская Н.С.., Химия. 9 кл.: Учебник.— М.: Русское слово»,2010
4.Новошинский И.И., Новошинская Н.С.., Сборник самостоятельных работ 9 кл.:— Краснодар:Совет.Кубань ,2012.
5.Новошинский И.И., Новошинская Н.С.., Программа курса, тематическое и поурочное планирование. 9 класс:— М.: Русское слово, 2008.
6.Новошинский И.И. Типы химических задач и способы их решения. 8-11 класс. ООО «Русское слово »,2012
7. Новошинский И.И., Новошинская Н.С.,Химия 9 кл. Тетрадь для практических работ. «ТИД «Русское слово» - РС», 2010.
8. Новошинский И.И., Новошинская Н.С.,Текущий и итоговый контроль по курсу «химия.9класс».М: «Руссое слово»,2013
Литература для учителя:
-Программа курса, тематическое и поурочное планирование. 9 класс: Новошинский И.И., Новошинская Н.С.., М.: Русское слово, 2008.
Литература для учащихся:
-Учебник: Химия. 9 кл.: Новошинский И.И., Новошинская Н.С.., М.: Русское слово»,2010
- Сборник самостоятельных работ 9 кл: Новошинский И.И., Новошинская Н.С.., Краснодар:Совет.Кубань ,2012.
- Химия 9 кл. Тетрадь для практических работ. Новошинский И.И., Новошинская Н.С., «ТИД «Русское слово» - РС», 2010.
Дополнительная литература:
Дидактический материал
Единые образовательные ресурсы с сайта www. school-coolection.edu.ru (единой коллекции образовательных ресурсов)
Химия (8-11 класс). Виртуальная лаборатория (учебное электронное издание)
«Образовательная система 2100»- http://www.school2100.ru
ФИПИ-http://www.fipi.ru/
ЭОР-http://fcior.edu.ru/
DVD «Кирилл и Мефодий. Электронные уроки по химии.8-11кл»
Интерактивное учебное пособие. Версия 2.0. Наглядная химия. 8-9кл.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Рабочая программа учебного курса «Химия» (9 кл.) (0.11 MB)
Рабочая программа учебного курса «Химия» (9 кл.) (0.11 MB)
 0
0 718
718 29
29 Нравится
0
Нравится
0


