
Урок в 9 классе

Цели урока:
- обеспечить усвоение учащимися знаний о фосфоре как о химическом элементе и простом веществе;
- аллотропных видоизменениях фосфора;
- повторить зависимость свойств вещества от его состава и строения;
- развивать умение сравнивать;
- способствовать формированию материалистического мировоззрения, нравственному воспитанию школьников.

Прав ли был Артур Конан-Дойл?

Открытие фосфора
Гамбургский алхимик
Хеннинг Бранд
1669 год
«Фосфор» -
от греческого «светоносный»

Фосфор как химический элемент
период
группа
валентных электронов
степени окисления
высший оксид
водородное соединение

Фосфор как химический элемент
период
III
V А
группа
валентных электронов
5
степени окисления
-3, +3, +5
высший оксид
Р 2 О 5
водородное соединение
РН 3

Сравните физические свойства
АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
Р
БЕЛЫЙ
КРАСНЫЙ
ЧЕРНЫЙ

БЕЛЫЙ ФОСФОР
Молекулы P 4 имеют форму тетраэдра. Это легкоплавкое t (пл)=44,1 о С, t (кип)=275 о С, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в сероуглероде и ряде других органических растворителей. Ядовит, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды.

Войска США
использовали фосфорные
Бомбы
в Ираке,
2004 г.
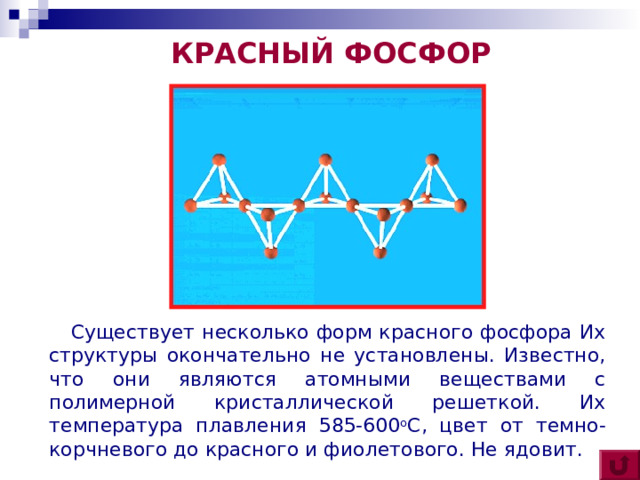
КРАСНЫЙ ФОСФОР
Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами с полимерной кристаллической решеткой. Их температура плавления 585-600 о С, цвет от темно-корчневого до красного и фиолетового. Не ядовит.
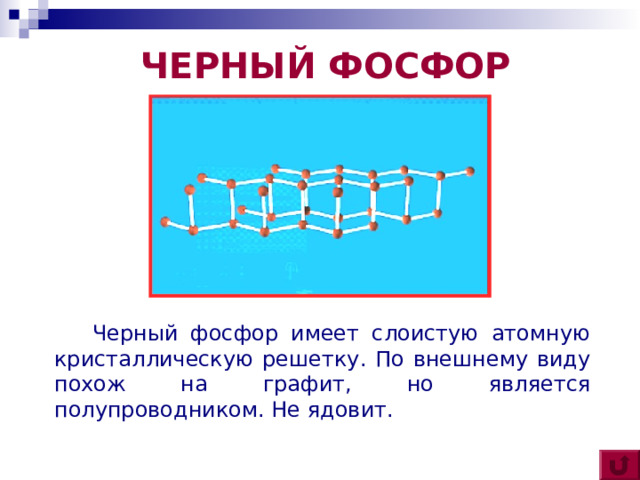
ЧЕРНЫЙ ФОСФОР
Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником. Не ядовит.
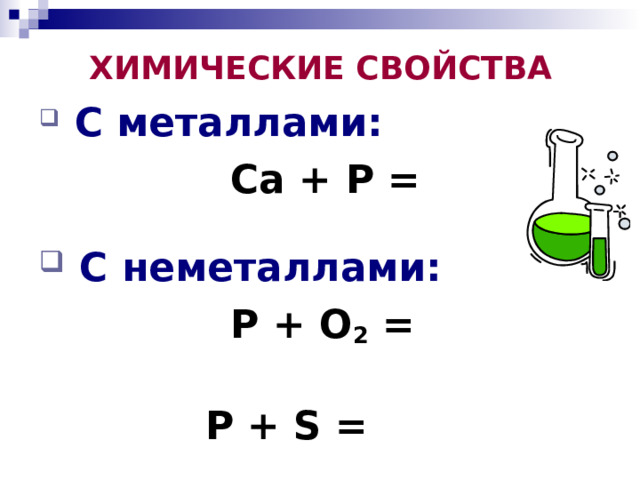
ХИМИЧЕСКИЕ СВОЙСТВА
- С металлами:
Ca + P =
- C неметаллами:
P + O 2 =
P + S =

- с бертолетовой солью при ударе взрывается, воспламеняется :
KClO 3 + P = P 2 O 5 + KCl
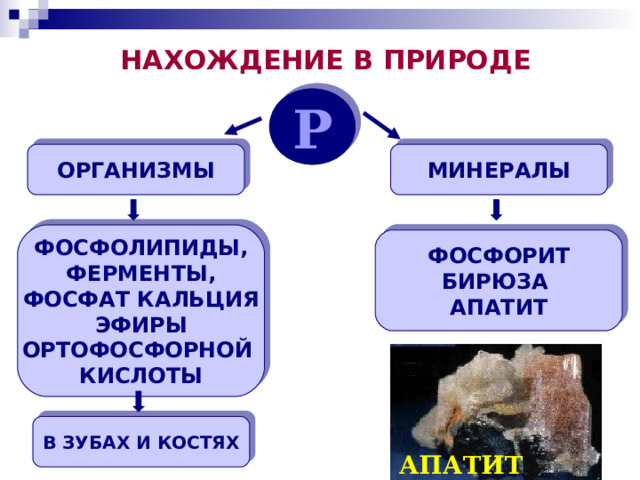
НАХОЖДЕНИЕ В ПРИРОДЕ
Р
ОРГАНИЗМЫ
МИНЕРАЛЫ
ФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
ФОСФОРИТ
БИРЮЗА
АПАТИТ
В ЗУБАХ И КОСТЯХ
АПАТИТ

Физиологическое действие белого фосфора
Результат применения чрезмерного количества фосфора
Появление лягушек с уродствами -результат применения фосфорных удобрений, которые смываются в реки и пруды ,
Фосфорный некроз – поражение челюстей

Получение фосфора
нагреванием смеси фосфорита, угля и
песка в электропечи:
Ca 3 (PO 4 ) 2 + C + SiO 2 → P 4 + CaSiO 3 + CO
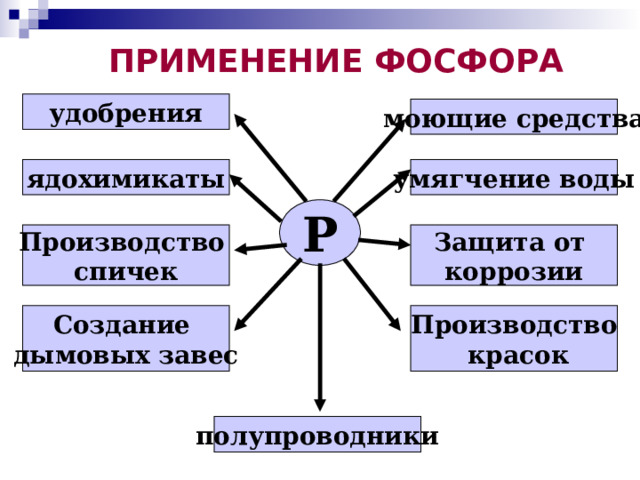
ПРИМЕНЕНИЕ ФОСФОРА
удобрения
моющие средства
умягчение воды
ядохимикаты
Р
Защита от
коррозии
Производство
спичек
Производство
красок
Создание
дымовых завес
полупроводники

Кислотный оксид Р 2 О 5 Физические свойства
- Белое гигроскопичное порошкообразное вещество.
- Хорошо растворимое в воде, образует несколько кислот.
- Используется как осушитель газов и жидкостей, отнимает воду у химических соединений.

Кислотный оксид Р 2 О 5 Химические свойства
- 1) с водой
- Р 2 О 5 + 3 Н 2 О = 2Н 3 РО 4
- (ортофосфорная кислота)
- Р 2 О 5 + Н 2 О = 2НРО 3
- (метафосфорная кислота)
- Р 2 О 5 + 2 Н 2 О = Н 4 Р 2 О 7
- (пирофосфорная кислота)

Кислотный оксид Р 2 О 5 Химические свойства
- 2) с основными оксидами
- Р 2 О 5 + 3 СаО = Са 3 (РО 4 ) 3
- 3) со щелочами
- Р 2 О 5 + 6 N а ОН = 2 N а 3 РО 4 + 3 Н 2 О

Ортофосфорная кислота Н 3 РО 4 Физические свойства
- Белые прозрачные кристаллы,
- не ядовита
- Кислота средней силы
- С водой смешивается в любых соотношениях.
- Тплав. = 42 0 С, плавиться без разложения, при умеренном нагревании разлагается.
- Окислительные свойства не проявляет (отличие от Н 2 SO 4 ( конц.), Н NO 3 )

Ортофосфорная кислота Н 3 РО 4
- Является трехосновной кислотой и образует три ряда солей:
- 1 ) средние соли , или фосфаты - Са 3 (РО 4 ) 3
- Которые нерастворимы в воде, кроме фосфатов щелочных металлов
- 2) Кислые - дигидрофосфаты - Са(Н 2 РО 4 ) 2
- Большинство из которых хорошо растворимы в воде

Ортофосфорная кислота Н 3 РО 4
- 3 ) Кислые - гидрофосфаты - СаНРО 4
- Которые малорастворимы в воде (кроме фосфатов натрия, калия и аммония), т.е. занимают промежуточное положение между фосфатами и дигидрофосфатами по растворимости.
- Вывод: с увеличением содержания атомов водорода в молекуле соли, ее растворимость повышается.

Ортофосфорная кислота Н 3 РО 4 Химические свойства
- Н 3 РО 4 проявляет все свойства кислот
- Реагирует:
- 1) со щелочами: NaOH, КОН
- 2) с основными оксидами: Li 2 O, Na 2 O
- 3) c солями: К 2 СО 3
- 4) с металлами не реагирует !!! ?
- (см.Таблицу растворимости)

Ортофосфорная кислота Н 3 РО 4 Химические свойства
- Фосфаты всех металлов (КромеЩМе) нерастворимы , поэтому на поверхности этих металлов образуется нерастворимая пленка, препятствующая их дальнейшему растворению в кислоте.
- ЩМе при растворении в кислоте, начинают взаимодействовать с водой.

Ортофосфорная кислота Н 3 РО 4 Химические свойства
- Некоторые реакции с металлами протекают в очень разбавленных растворах:
2 Н 3 РО 4 (разб) + 3 М g = М g 3 (РО 4 ) 2↓ + 3Н2↑

Качественная реакция на фосфат-ион РО 4 3-
- РО 4 3- + 3 Ag + = Ag 3 РО 4 ↓ ( желтый фосфат серебра)
- Полученный осадок растворяется в сильных кислотах.
- По этому признаку его можно отличить от других нерастворимых солей серебра желтого цвета – AgI, AgBr
- AgCl – белого цвета

ПОВТОРИМ
1.ЗАКОНЧИТЕ УРАВНЕНИЯ : Р + F 2 = Al + P = Укажите окислитель и восстановитель
2 . Задача:
Какова масса фосфора в вашем теле, если известно, что фосфор составляет ≈1% от массы тела?
3 .Осуществите превращения:
Р РН 3 Р 2 О 5 Н 3 РО 4

Тест
1.Тип кристаллической решетки у белого фосфора….
а) молекулярный б) атомный в) ионный
а) молекулярный Р4
2. У фосфора….. аллотропных модификаций
а) две б) три в) четыре г) пять
в) четыре – белый, черный, красный, фиолетовый
3. В атоме фосфора неспаренных электронов -…
а) три б) четыре в) пять
а) три
4. В реакции…. Фосфор проявляет восстановительные свойства
а)4Р+5О 2 =2Р 2 О 5 б)2Р+3 Mg = Mg 3 P 2 в)2Р+3Н 2 =2РН 3
а)4Р+5О 2 =2Р 2 О 5

Тест
5. Причина свечения белого фосфора….
а)изменение агрегатного состояния вещества
б) химическое явление в) физическое явление
б) химическое явление
6.Как называются соединения фосфора с металлами
а) сульфаты б)фосфаты в) фосфиды
в) фосфиды
7.Какой тип связи в молекуле фосфина РН 3
а) ковалентная неполярная б) ковалентная полярная в) ионная
а) ковалентная неполярная
8) Красный или белый фосфор ядовит?
а) красный б) белый
б) белый
9) Очень ядовит, с неприятным запахом, легко воспламеняется на воздухе, образует болотные блуждающие огни. О каком газе идет речь?
О фосфине РН 3


 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация фосфор (827 KB)
Презентация фосфор (827 KB)
 0
0 30
30 27
27 Нравится
0
Нравится
0


