
Тема урока:
подготовила учитель химии Мещерякова Т.А.
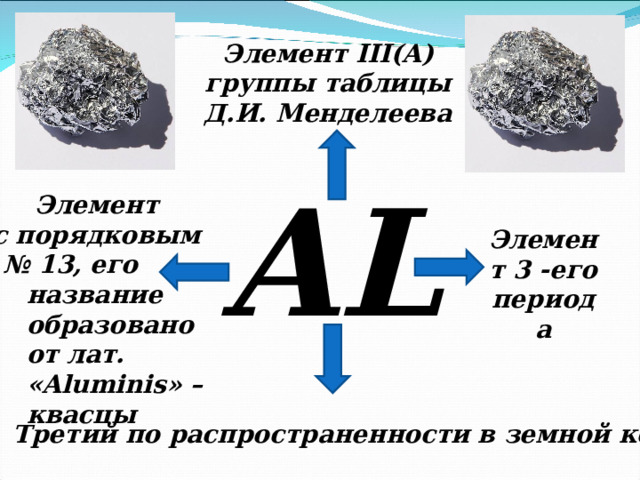
Элемент III ( A )
группы таблицы
Д.И. Менделеева
AL
Элемент
с порядковым
№ 13, его
Элемент 3 -его
периода
название
образовано от лат. « Aluminis » – квасцы
Третий по распространенности в земной коре

Датский физик
Ганс Эрстед
(1777-1851)
Впервые алюминий был получен им
в 1825 году действием амальгамы калия
на хлорид алюминия с последующей отгонкой ртути.

Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и французом Полем Эру в 1886 году.
Он заключается в растворении оксида алюминия в расплаве криолита с последующим электролизом с использованием расходуемых коксовых или графитовых электродов.

Холл Чарльз
(1863 – 1914) американский инженер-химик
Будучи студентом Оберлинского колледжа,
он узнал, что можно разбогатеть и получить благодарность человечества,
если изобрести способ получения алюминия
в промышленных масштабах.
Как одержимый, Чарльз проводил эксперименты
по выработке алюминия путем
электролиза криолитно-глиноземного
расплава.
23 февраля 1886 года спустя год
после окончания колледжа Чарльз получил с помощью электролиза первый алюминий.

Поль Эру (1863-1914) –
французский
инженер - химик
В 1889 году открыл алюминиевый завод во Фроне (Франция), став его директором, он сконструировал электродуговую печь для выплавки стали, названную его именем; он разработал также электролитический способ получения алюминиевых сплавов

Важнейшим на сегодня минералом алюминия является боксит
Основной химический компонент боксита - глинозем (Al 2 O 3 )
(28 - 80%).
Нахождение в природе

Алюмосиликаты:
- Глина – Al 2 O 3 *nSiO 2 *mH 2 O
- Бокситы – Al 2 O 3 *nH 2 O
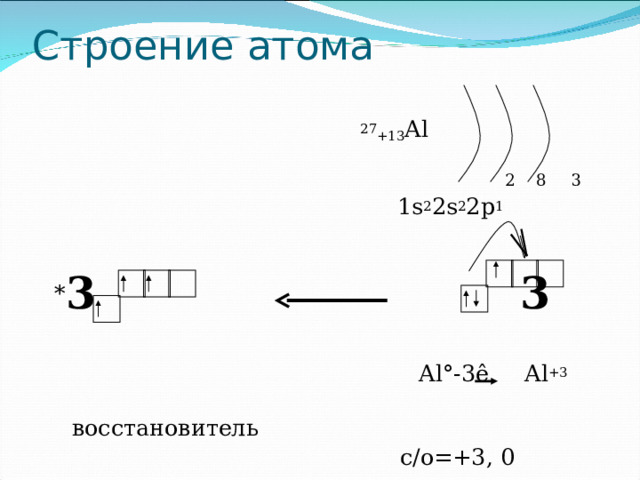
Строение атома
27 +13 Al
2 8 3
1s 2 2s 2 2p 1
* 3 3
Al °-3ê Al +3
восстановитель
с / о=+3, 0

ФИЗИЧЕСКИЕ СВОЙСТВА
Al - серебристо-белый металл
Мягкий, пластичный (легко вытягивается в проволоку и раскатывается в листы), легкий (плотность 2,7г/см3)
Хорошо проводит тепло и электрический ток
Температура плавления - 660 ° С
Особо чистый А l хорошо отражает солнечные лучи
ВАЖНО
Занимает 1-е место в земной коре среди металлов

ХИМИЧЕСКИЕ СВОЙСТВА
Al – активный металл. На воздухе всегда покрыт пленкой Al 2 O 3 . Поэтому при обычных условиях не вступает во взаимодействие с другими веществами.

ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
При обычных условиях
- Взаимодействие с кислородом, образуя оксид алюминия:
4 Al+ 3O 2 =2Al 2 O 3 +Q
- Взаимодействие с галогенами образуя бромид алюминия
2Al+ 3Br 2 =2Al 2 Br 3
с хлором, образуя хлорид алюминия:
2 Al + 3Cl 2 = 2AlCl 3
- 2Al+ 3Br 2 =2Al 2 Br 3 с хлором, образуя хлорид алюминия: 2 Al + 3Cl 2 = 2AlCl 3
При нагревании
- Взаимодействие с углеродом образуя карбид алюминия:
4 Al+3C=Al 4 C 3 (1500-1700°C)
- Взаимодействие с серой с серой, образуя сульфид алюминия:
2Al+3S= Al 2 S 3 (150-170°C)

Взаимодействие со сложными веществами
- Взаимодействие с водой (очищенный от оксидной пленки)
Al +H 2 O=Al(OH) 3 +H 2
Подберите коэффициенты

Взаимодействие со сложными веществами
- Взаимодействие с водой (очищенный от оксидной пленки)
2 Al + 6 H 2 O= 2 Al(OH) 3 + 3 H 2
- Взаимодействует с растворами кислот
Al +HCl= AlCl 3 + H 2
Подберите коэффициенты
![Взаимодействие со сложными веществами Взаимодействие с водой (очищенный от оксидной пленки) 2 Al + 6 H 2 O= 2 Al(OH) 3 + 3 H 2 Взаимодействует с растворами кислот 2Al +6HCl= 2AlCl 3 + 3H 2 Взаимодействует с растворами щелочей Al+ NaOH + H 2 O=Na[Al(OH) 4 ]+H 2 тетрагидроксоалюминат натрия Подберите коэффициенты](https://fsd.videouroki.net/html/2024/03/11/v_65ee7df3858c7/img14.jpg)
Взаимодействие со сложными веществами
- Взаимодействие с водой (очищенный от оксидной пленки)
2 Al + 6 H 2 O= 2 Al(OH) 3 + 3 H 2
- Взаимодействует с растворами кислот
2Al +6HCl= 2AlCl 3 + 3H 2
- Взаимодействует с растворами щелочей
Al+ NaOH + H 2 O=Na[Al(OH) 4 ]+H 2
тетрагидроксоалюминат
натрия
Подберите коэффициенты
![Взаимодействие со сложными веществами Взаимодействие с водой (очищенный от оксидной пленки) 2 Al + 6 H 2 O= 2 Al(OH) 3 + 3 H 2 Взаимодействует с растворами кислот 2Al +6HCl= 2AlCl 3 + 3H 2 2Al + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2 разб. Взаимодействует с растворами щелочей 2 Al+ 2 NaOH + 6 H 2 O= 2 Na[Al(OH) 4 ]+ 3 H 2 тетрагидроксоалюминат натрия](https://fsd.videouroki.net/html/2024/03/11/v_65ee7df3858c7/img15.jpg)
Взаимодействие со сложными веществами
- Взаимодействие с водой (очищенный от оксидной пленки)
2 Al + 6 H 2 O= 2 Al(OH) 3 + 3 H 2
- Взаимодействует с растворами кислот
2Al +6HCl= 2AlCl 3 + 3H 2
2Al + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2
разб.
- Взаимодействует с растворами щелочей
2 Al+ 2 NaOH + 6 H 2 O= 2 Na[Al(OH) 4 ]+ 3 H 2
тетрагидроксоалюминат
натрия

Алюминий при обычных условиях не взаимодействует с концентрированными H 2 SO 4 и HNO 3
ПРИ НАГРЕВАНИИ
8 Al + 15 H 2 SO 4 = 4 Al 2 (SO 4 ) 3 + 3 H 2 S + 12 H 2 O
Al + HNO 3 = Al (NO 3 ) 3 + 3 NO 2 + 3H 2 O

Al + H 3 PO 4 = не возможно
Al + H 3 PO 4 AlPO 4 + H 2
НО образуется нерастворимая соль AlPO 4 .
Доступ кислоты H 3 PO 4 к алюминию невозможен.
Реакция прекращается.
Оксид алюминия
( AL 2 O 3 )
Соединения алюминия
Гидроксид алюминия
AL(OH) 3

Соединения алюминия. Оксид
- Очень твердый порошок белого цвета.
- Образуется:
а) при окислении или горении алюминия:
4 Al + 3O 2 = 2Al 2 O 3
б) в реакции алюминотермии:
2 Al + Fe 2 O 3 = 2 Fe + Al 2 O 3
в) при термическом разложении гидроксида:
2Al(OH) 3 = Al 2 O 3 + H 2 O
![Химические свойства оксида алюминия Al 2 O 3 амфотерный оксид Взаимодействует: а) с кислотами: Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2 O Al 2 O 3 + 6H + + 3SO 4 2- = 2Al 3+ + 3SO 4 2- + 3H 2 O Al 2 O 3 + 6H + = 2Al 3+ + 3H 2 O б) со щелочами: Al 2 O 3 + 6NaOH = 2Na 3 AlO 3 + 3H 2 O Al 2 O 3 + 6Na + + 6OH - = 6Na + + 2AlO 3 3- + 3H 2 O Al 2 O 3 + 6OH - = 2AlO 3 3- + 3H 2 O Al 2 O 3 + 2NaOH + 3H 2 O 2Na[Al(OH) 4 ]](https://fsd.videouroki.net/html/2024/03/11/v_65ee7df3858c7/img20.jpg)
Химические свойства оксида алюминия
Al 2 O 3 амфотерный оксид
Взаимодействует:
а) с кислотами:
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2 O
Al 2 O 3 + 6H + + 3SO 4 2- = 2Al 3+ + 3SO 4 2- + 3H 2 O
Al 2 O 3 + 6H + = 2Al 3+ + 3H 2 O
б) со щелочами:
Al 2 O 3 + 6NaOH = 2Na 3 AlO 3 + 3H 2 O
Al 2 O 3 + 6Na + + 6OH - = 6Na + + 2AlO 3 3- + 3H 2 O
Al 2 O 3 + 6OH - = 2AlO 3 3- + 3H 2 O
Al 2 O 3 + 2NaOH + 3H 2 O 2Na[Al(OH) 4 ]

сапфир
рубин
AL 2 O 3
Глинозём
Корунд
Боксит

Применение сапфиров
знаменитые сапфиры английской королевской семьи

Применение рубинов
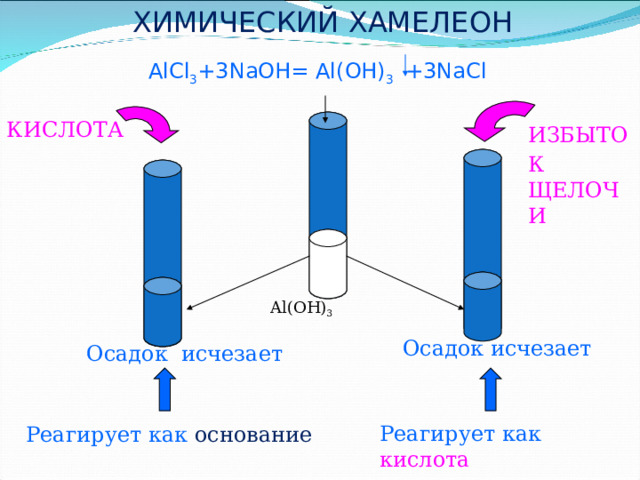
ХИМИЧЕСКИЙ ХАМЕЛЕОН
AlCl 3 +3NaOH= Al(OH) 3 +3NaCl
КИСЛОТА
ИЗБЫТОК
ЩЕЛОЧИ
Al(OH) 3
Осадок исчезает
Осадок исчезает
Реагирует как кислота
Реагирует как основание
![Химические свойства гидроксида алюминия Разлагается при нагревании Амфотерный 2 AL(OH) 3 = AL 2 О 3 + 3 H 2 O Реагирует с кислотами AL(OH) 3 + 3 HCL = ALCL 3 + 3 H 2 O Реагирует с щелочами AL(OH) 3 + NaOH = N а [ AL(OH) 4 ]](https://fsd.videouroki.net/html/2024/03/11/v_65ee7df3858c7/img25.jpg)
Химические свойства
гидроксида алюминия
Разлагается при
нагревании
Амфотерный
2 AL(OH) 3 = AL 2 О 3 + 3 H 2 O
Реагирует с кислотами
AL(OH) 3 + 3 HCL = ALCL 3 + 3 H 2 O
Реагирует с щелочами
AL(OH) 3 + NaOH = N а [ AL(OH) 4 ]
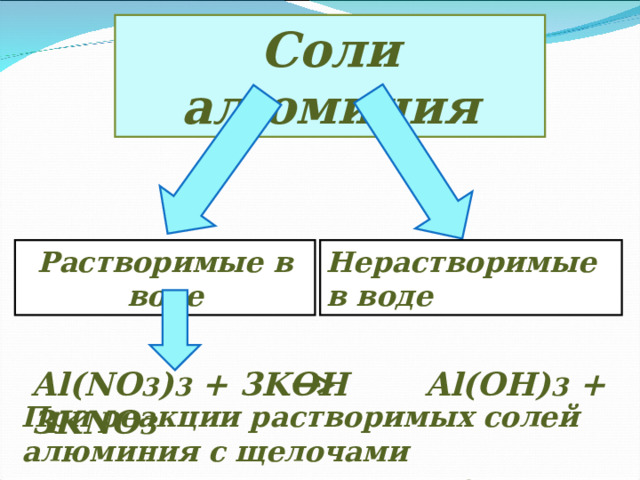
Соли алюминия
Растворимые в воде
Нерастворимые в воде
Al(NO 3 ) 3 + 3KOH Al(OH) 3 + 3KNO 3
При реакции растворимых солей алюминия с щелочами получается гидроксид алюминия

Гель из гидроксида алюминия входит в состав лекарст для лечения болезней желудка.
Гидроксид алюминия используется для очистки воды, т. к. обладает способностью поглощать различные вещества.
Оксид алюминия в виде корунда используется как образивный материал для обработки металлических изделий.
Оксид алюминия в виде рубина широко используется в лазерной технике.
Оксид алюминия применяется в качестве катализатора, для разделения веществ в хроматографии.
Хлорид алюминия AlCl3 – катализатор в производстве органических веществ.

Э Т О И Н Т Е Р Е С Н О:
- Алюминий найдет свое место и в производстве новой так называемой «умной» одежды . Уже сейчас производители создали ткань, покрытую тонким слоем этого металла, которая получила название алюминированная ткань.
Обладая интересными свойствами, такими как последовательное согревание и охлаждение, она может
применяться в различных областях.
Например, если на окне висят занавески, выполненные из этой ткани, то они будут отражать тепловые лучи в жаркие дни, но пропустят свет. Таким образом, в комнате будет прохладно и светло. Зимой занавески можно перевернуть металлической стороной в комнату, это позволит вернуть тепло в помещение. Такую ткань можно считать универсальной — обладатель плаща из нее может не опасаться ни зноя, ни холода. При этом в зависимости от погоды плащ нужно перевернуть той или иной стороной.

Проверьте себя:
Вставьте пропущенные слова в текст:
Алюминий – это металл, у которого в соединениях степень окисления равна .
В природе он встречается в виде .
+3
оксида алюминия
водой
Алюминий может вступать в реакцию с , образуя гидроксид алюминия, который обладает
.
амфотерностью
Алюминий вступает в реакцию для восстановления менее активных металлов из их оксидов
алюминотермии

- Подберите коэффициенты методом электронного баланса:
- Al + H 2 SO 4 = Al 2 (SO 4 ) 3 + SO 2 + H 2 O
- Al + HNO 3 = Al(NO 3 ) 3 + NO 2 + H 2 O
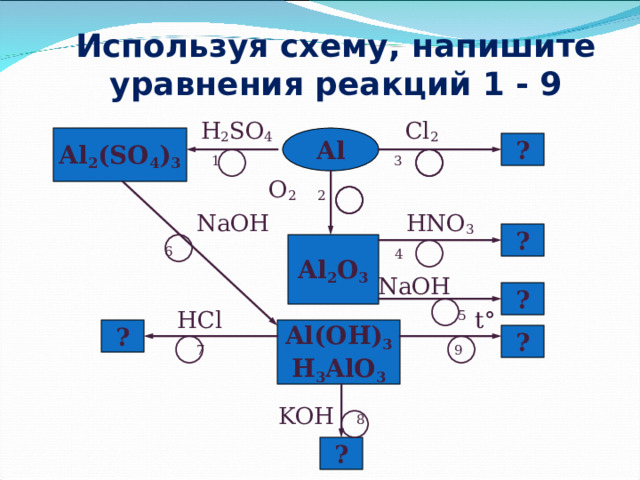
Используя схему, напишите уравнения реакций 1 - 9
H 2 SO 4 Cl 2
1 3
O 2 2
NaOH HNO 3
6 4
NaOH
HCl 5 t °
7 9
KOH 8
Al 2 (SO 4 ) 3
Al
?
?
Al 2 O 3
?
?
Al(OH) 3
H 3 AlO 3
?
?

Какие из соединений вступят в реакцию с алюминием:
Cl 2
K 2 O
CuSO 4
H 2 O
S
BaSO 4
HCL
Fe 2 O 3
Cr

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация Алюминий (4.13 MB)
Презентация Алюминий (4.13 MB)
 0
0 86
86 20
20 Нравится
0
Нравится
0


