Цели урока:
Образовательная: Ввести понятие термодинамических величин.
Развивающая: Развивать память, воображение, догадку и сообразительность, логическое и творческое мышление.
Воспитательная: формирование взаимопомощи, доброжелательного отношения друг к другу, развивать культуру общения и культуру ответа на вопросы, умение выслушать других при работе в классе, в группах.
Задачи урока:
1. Способствовать формированию и развитию умений применять законы физики для объяснения процессов, протекающих в окружающем мире, доказывать и обосновывать свою точку зрения.
2. Способствовать развитию речи, мышления, сенсорной (восприятие внешнего мира через органы чувств) сферы личности
3. Способствовать формированию и развитию коммуникативных навыков и навыков сотрудничества в процессе работы в группах.
4. Способствовать формированию самооценки и критического мышления.
Цели для учащихся:
знать определения, классификацию, область применения данных законов;
уметь записывать количественные зависимости между термодинамическими параметрами в газовых законах;
уметь предсказывать изменения, происходящие с газом при переходе его из одного состояния в последующее;
уметь анализировать и конкретизировать данную ситуацию.
Методы работы: творческий, частично поисковый. Формы работы: коллективные.
Технические средства обучения:
компьютер, мультимедийный проектор;
мультимедийная презентация, флипчарт (.festival.1september.ru/articles/595356/pril1.ppt)
Ход урока
ВСЕСТОРОННЯЯ ПРОВЕРКА ЗНАНИЙ.
работа на повторение с терминами и формулами.
|
Термины |
Формулы |
|
1.Основные положения МКТ (сформулировать) 2.Дать определение идеального газа. 3.Дать определение температуры 4.Назвать макропараметры 5.Что называют изопроцессом? 6.Назвать газовые законы. |
N=m|?Na P=?nm0v2 ?=N|V P=2|3n? E=3|2?T P=?kT pv=?RT |
Цель нашего сегодняшнего урока.
Повторить полученные знания по этой теме, обобщить их, найти им применение при решении некоторых интересных задач. Для этого нужны не только ваши знания, но и ваши любознательность, наблюдательность, а главное желание думать.
ПОДГОТОВКА К АКТИВНОМУ УСВОЕНИЮ.
Тепловые явления в физике изучаются с двух точек зрения. Это термодинамической и молекулярно- кинетической. они противоречат и дополняют друг друга.
ОБЪЯСНЕНИЕ ТЕМЫ
Определение: Термодинамика – наука о закономерностях превращения энергии.
Определение: Термодинамической системой называется совокупность материальных тел, взаимодействующих, как между собой, так и с окружающей средой.
Из курса физики 8 класса мы знаем, что внутренняя энергия тела – сумма кинетической энергии хаотического теплового движения частиц (атомов или молекул) тела и потенциальной энергии их взаимодействия.
Все макроскопические тела обладают энергией – внутренней. От чего же она зависит?
Под внутренней энергией (U) понимается вся энергия системы (тела). Что именно входит во внутреннюю энергию системы?
Поскольку состояние термодинамической системы (например, газа) определяется величинами m, μ, V, T (давление P само определяется этими же величинами), то от них должна зависеть и внутренняя энергия U.
- внутренняя энергия данной массы идеального газа зависит лишь от одного макроскопического параметра – термодинамической температуры
Способы изменения внутренней энергии идеального газа. Ставим перед учащимися проблемный в о п р о с: как можно изменить внутреннюю энергию тела?
Чтобы ответить на него, выполняем ряд опытов:
нагреваем небольшое количество воды в пробирке, закрытой плотно пробкой;
потерли ладони друг о друга, монетку прижали к столу и подвигали по столу.
Учащиеся делают в ы в о д: внутреннюю энергию тела можно изменить двумя способами:
совершением механической работы;
путем теплопередачи
Значит основные величины термодинамики внутренняя энергия, количество теплоты и работа.
Следовательно А и Q – характеристики процесса изменения (U) внутренней энергии
Количество теплоты Q – часть внутренней энергии, переданной в процессе теплообмена от одного макроскопического тела к другому без совершения работы
Работа в термодинамике А перемещение частей макроскопического тела относительно друг друга
Энергия в природе не возникает из ничего и не исчезает : количество энергии неизменно, она только переходит из одной формы в другую.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы
U энергии системы при переходе её из одного состояния в другое равно сумме А внешних сил и Q , переданного системе: U =А + Q
4.ЗАКРЕПЛЕНИЕ ТЕМЫ
Работа с диаграммой – смотрите документ.
Итоговый тест по вариантам – смотрите документ
РЕФЛЕКСИЯ
Что нового узнали?
С какими трудностями столкнулись?
Ему вы учились?
Что тебе пригодится и далее?
Домашнее задание:§5-1,-5-4
творческая работа “Тепловые параметры в природе.” (презентация)
Цель: используя справочные данные, дайте оценку термодинамическим параметрам а окружающем вас мире.

 Получите свидетельство
Получите свидетельство Вход
Вход







 V
V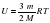 - внутренняя энергия данной массы идеального газа зависит лишь от одного макроскопического параметра – термодинамической температуры
- внутренняя энергия данной массы идеального газа зависит лишь от одного макроскопического параметра – термодинамической температуры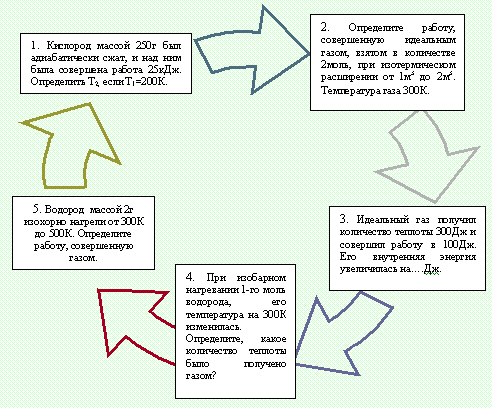












 Основы термодинамики (38.87 КB)
Основы термодинамики (38.87 КB)
 2
2 1763
1763 281
281 Нравится
0
Нравится
0



