«Мне было бы весьма интересно присутствовать при установке данных для доказательства превращения элементов друг в друга. Потому что я тогда мог бы надеяться на то, что причина периодической законности будет открыта и понята.»
Д.И. Менделеев
Актуальность.
1 марта 2019 года исполняется 150 лет со дня открытия Периодического закона Дмитрия Ивановича Менделеева.
Почему мы выбрали Периодический закон для своего сообщения? Потому, что чем больше узнаёшь о нём, тем больше возникает вопросов.
Цель: с помощью различных публикаций, изучить вопросы об истории открытия Периодического закона, его взаимосвязь с биологией, философией; доказать значимость одного из величайших открытий XIX века.
Задачи
изучить историю открытия Периодического закона. Работы предшественников (Дёберейнера, Шанкуртуа, Ньюлендса, Мейера)
проанализировать связь П. закона с законами гегелевской диалектики и проиллюстрировать её с помощью эксперимента
найти подтверждение тому, что закон продолжает «работать» до сих пор благодаря открытию новых трансурановых элементов
Гипотеза
Мы считаем, что Периодический закон – это живая система, которая продолжает развиваться.
1.История открытия Периодического закона
Периодический закон был открыт Д. И. Менделеевым в ходе работы над текстом учебника «Основы химии», когда он столкнулся с трудностями систематизации фактического материала. К середине февраля 1869 г., обдумывая структуру учебника, учёный постепенно пришёл к выводу, что свойства простых веществ и атомные массы элементов связывает некая закономерность.
17 февраля (1 марта) 1869 г. Д.И. Менделеев сдал в набор рукопись «Опыт системы элементов, основанной на их атомном весе и химическом сходстве».
(слайд 3) Первую попытку систематизации элементов предпринял немецкий химик Иоганн Дёберейнер, сформулировавший в 1829 году закон триад. Дёберейнер обратил внимание на то, что в рядах сходных по свойствам элементов наблюдается закономерное изменение атомной массы.
Александр де Шанкуртуа располагал все известные в то время химические элементы в единой последовательности возрастания их атомных масс и полученный ряд наносил на поверхность цилиндра по линии, исходящей из его основания под углом 45° к плоскости основания. При развертывании поверхности цилиндра оказывалось, что на вертикальных линиях, параллельных оси цилиндра, находились химические элементы со сходными свойствами. Так, на одну вертикаль попадали литий, натрий, калий; бериллий, магний, кальций; кислород, сера, селен, теллур и т. д. Недостатком спирали де Шанкуртуа было то обстоятельство, что на одной линии с близкими по своей химической природе элементами оказывались при этом и элементы совсем иного химического поведения. В группу щелочных металлов попадал марганец, в группу кислорода и серы — ничего общего с ними не имеющий титан.
(слайд 4) Далее учёный Джон Ньюлендс сделал попытку сопоставить химические свойства элементов с их атомными массами. Расположив элементы в порядке возрастания их атомных масс, Ньюлендс заметил, что сходство в свойствах проявляется между каждым восьмым элементом. Найденную закономерность Ньюлендс назвал законом октав по аналогии с семью интервалами музыкальной гаммы. В своей таблице он располагал химические элементы в вертикальные группы по семь элементов в каждой и при этом обнаружил, что (при небольшом изменении порядка некоторых элементов) сходные по химическим свойствам элементы оказываются на одной горизонтальной линии.
В 1864 году Мейер опубликовал в своей книге «Новейшие теории химии и их значение для химической статики» таблицу, в которую были включены 28 элементов, размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в этой таблице, чтобы подчеркнуть закономерное изменение атомной массы в рядах подобных элементов, а соотношения атомных масс и валентностей ещё 22 элементов рассматривались в другой таблице. Объединённая таблица, подготовленная им в 1868 г. для второго издания своей книги, была опубликована лишь в 1895 году, в ней 52 элемента размещались в 15 столбцах. Следующую таблицу Мейер предложил в вышедшей в 1870 году статье, содержавший также график зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид. Таблица "Природа элементов как функция их атомного веса состояла из девяти вертикальных столбцов, сходные элементы располагались в горизонтальных рядах; некоторые ячейки таблицы Мейер оставил незаполненными.
(слайд 5) Что же был призван объяснить периодический закон? Прежде всего - характер (еще не причины!) взаимосвязей между элементами. Они угадывались уже до Менделеева. Число известных элементов и выявленных свойств позволяло это сделать (в начале XIX в. химики знали около 40 химических элементов, только что Дэви получил щелочные металлы). А во-вторых, вскоре выяснилось, что величины масс атомных элементов подчиняются правилу среднего арифметического:
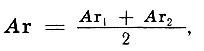 а это означало, что найдена закономерность.
а это означало, что найдена закономерность.
(слайд 6) Менделеев понял, что нужно одной идеей - периодической повторяемости свойств у высших форм соединений - объединить элементы. Первый вариант Периодической таблицы, опубликованный Менделеевым в 1869 году, выглядит непривычно для современников. Пока не проставлены атомные номера, будущие группы элементов расположены горизонтально (а будущие периоды - вертикально), еще не открыты инертные газы, встречаются незнакомые символы элементов, многие атомные массы заметно отличаются от современных. Однако нам важно видеть, что уже в первый вариант Периодической таблицы Д. И. Менделеев включал больше элементов, чем их было открыто на тот момент! Он оставил свободными 4 клеточки своей таблицы для еще неизвестных элементов и даже смог правильно оценить их атомный вес. Атомные единицы массы (а.е.м.) тогда еще не были приняты и атомные веса элементов измеряли в "паях", близких по значению к массе атома водорода.
1.2 Периодический закон и строение атома
До конца XIX века Периодический закон опирался на представление о неделимости атома. Незыблемость этих представлений была нарушена, когда французский химик Анри Беккерель открыл радиоактивность урана, а Мари Склодовская-Кюри и Пьер Кюри открыли другие радиоактивные элементы – радий и полоний.
Английский физик Эрнст Резерфорд, изучая столкновение альфа-частиц с тонкой золотой фольгой, пришёл к мысли, что в центре атома находится ядро, в котором сосредоточена вся масса атома. (слайд 7) Только ли по массе отличаются ядра элементов? Поставим на пути α-частиц пластинки из разных металлов. Угол отклонения α-частицы зависит от заряда ядра. Используя углы отклонения и учитывая целый ряд факторов, учёные вычислили заряды атомов химических элементов, приняв за единицу заряда заряд атома ядра водорода. Численное значение заряда ядра оказалось равным порядковому номеру элемента. (слайд 8) Гениальность открытия Менделеева в том, что. опираясь на знание химических свойств, вопреки значениям атомных масс, он верно определил места теллура и йода, кобальта и никеля, аргона и калия (слайд 9).
В настоящее время Периодический закон формулируется так: «Свойства химических элементов находятся в периодической зависимости от заряда атомных ядер» (слайд 10).
1.3 Периодический закон и законы диалектики
Открытие периодического закона и создание системы химических элементов имело огромное значение не только для химии, но и для философии, для всего нашего миропонимания. Менделеев показал, что химические элементы составляют стройную систему, в основе которой лежит фундаментальный закон природы. В этом нашло выражение положение материалистической диалектики о взаимосвязи и взаимообусловленности явлений природы.
Периодичность в природе представлена не только периодическим законом. Часто можно наблюдать, что состояние того или иного объекта полностью повторяется через определённые промежутки времени: движение космических тел вокруг центра Галактики, движение тел вокруг центрального светила, движение электронов вокруг ядра. В процессе развития происходит повторение состояния объекта, но оно неполное, это кажущийся возврат к старому.
Закон отрицания отрицания
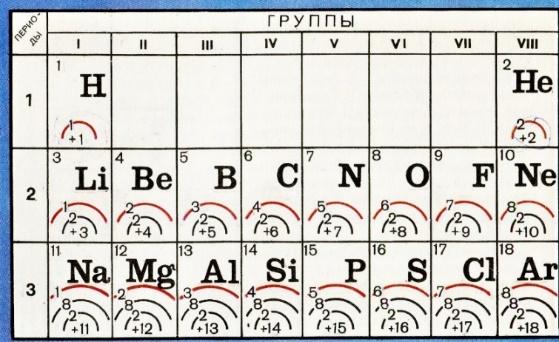
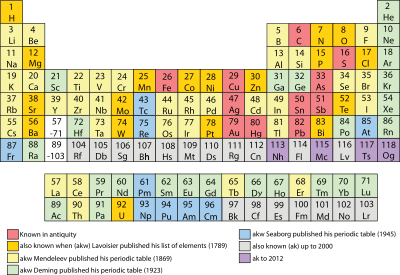
Примером может служить знакомая Периодическая таблица элементов Менделеева. Из приведённого фрагмента видно, что каждый период начинается более активным металлом, чем предыдущий: натрий более активный металл, чем литий, калий ещё более активный, чем натрий. В направлении сверху вниз нарастают металлические свойства: в каждом последующем периоде свойства элементов предыдущего периода повторяются, но это неполное повторение. Закон отрицания отрицания заключается в том, что новое всегда отрицает старое и занимает его место, но постепенно уже само превращается из нового в старое и отрицается более новым.
(слайд 11) Щелочной металл Li в конце 2 периода отрицается инертным газом Ne (число электронных слоев 2, но внешний слой уже 8 ē – это не щелочной металл), который, в свою очередь, отрицается щелочным металлом следующего 3 периода – Na (появляется новый электронный слой → резкий скачок в свойствах. Na сходен с Li, но имеет уже более сложное строение, поэтому Na как бы отрицает литий, но на более высоком уровне).
Закон отрицания отрицания в обычной жизни выглядит так: чтобы шагнуть на следующую ступень развития, должно быть невозможным пребывание на нынешней ступени. Сейчас в мире накапливаются факторы, которые делают невозможным выживание человечества в рамках привычного мышления и отношения к окружающему миру (например, экологические, геополитические).
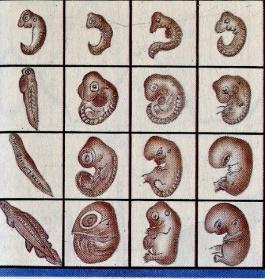
Вас не удивляет, что рядом с фрагментом таблицы Менделеева, иллюстрация к биогенетическому закону? Здесь тоже проявляется неполная повторяемость: каждая особь в индивидуальном развитии (онтогенезе) повторяет историю развития своего вида (филогенез) – онтогенез есть краткое повторение филогенеза.
Внутри атома аргона «спрятан» атом неона, а в начале жизни человеческого зародыша – зародыш рыбы или ящерицы. Но, разумеется повторение неполное - иначе из него развилась бы рыба или ящерица.
(слайд 12) В живой природе встречается и полная повторяемость, т. к. повторяемость, ритм – это форма существования всего живого. Нарушение ритма – нарушение жизнедеятельности всего организма.
На иллюстрации показаны ритмы солнечной активности, ритмы ионизации атомов в Периодической таблице и электрокардиограмма работы сердца. Это – подтверждение закона отрицания отрицания.
Второй закон диалектики – закон перехода количества в качество.
(слайд 13) Вскрывая зависимость между свойствами химических элементов и массой их атомов, периодический закон явился блестящим подтверждением одного из всеобщих законов развития природы — закона перехода количества в качество.
Периодический закон, отобразив одно из важнейших положений диалектики, показал, что химические элементы являются сложными образованиями из более простых форм материи, итогом поступательного развития материи от низшего к высшему. Периодический закон показывает путь развития химических элементов от наиболее легкого к наиболее тяжелому— от водорода (Н) к оганесону (Og). Каждый последующий элемент в периодической системе сложнее и богаче предыдущего.
Менделеев доказал, что в рядах сходных элементов, расположенных по атомным весам, имеются различные пробелы, указывающие на то, что здесь должны быть еще открыты новые элементы. Он наперед описал общие химические свойства одного из этих неизвестных элементов, — названного им экаалюминием, потому что в начинающемся с алюминия ряду он непосредственно следует за алюминием, — и предсказал приблизительно его удельный и атомный вес и его атомный объем. Несколько лет спустя Лекок-де-Буабодран действительно открыл этот элемент, и оказалось, что предсказания Менделеева оправдались с совершенно незначительными отклонениями. Экаалюминий получил свою реализацию в галлии... Менделеев, применив бессознательно гегелевский закон о переходе количества в качество, совершил научный подвиг, который смело можно поставить рядом с открытием Леверье, вычислившего орбиту еще неизвестной планеты — Нептуна.
Мы провели химический эксперименты, доказывающие, что законы диалектики можно применить к химической реакции.
(слайд 14) Скорость реакции различных металлов с водой зависит от числа валентных электронов и радиуса атома - иллюстрирует переход количества в качество. Литий находится во втором периоде таблицы. Следовательно, у него один электрон на втором энергетическом уровне. Скорость реакции лития и кальция с водой почти одинакова. Признаков реакции магния мы вообще не наблюдали. Магний оказался наименее реакционноспособным из трёх металлов. У него меньше радиус атома, чем у кальция и больше электронов на последнем энергетическом уровне, чем у лития.
Закон единства и борьбы противоположностей
Закон единства и борьбы противоположностей заключается в том, что всё сущее состоит из противоположных начал, которые будучи едиными по своей природе, находятся в борьбе и противоречат друг другу (день-ночь, катион-анион, металл-неметалл, основность – кислотность). Единство и борьба противоположных начал – внутренний источник движения и развития всего сущего (слайд 15)
Амфотерные соединения
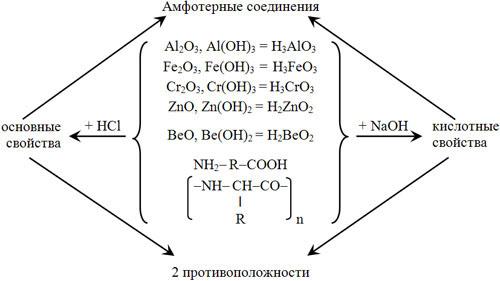
Существование амфотерных соединений говорит о том, что между веществами с основными свойствами и кислотными свойствами нельзя провести резкую границу. В природе не существует резких границ.
(слайд 16) Мы провели два опыта в подтверждение этого закона.
1. Образование желтого осадка иодида свинца – иллюстрирует закон единства и борьба противоположностей. Бесцветные ионы свинца и ионы йода образуют соединение жёлтого цвета. Pb2++ 2I- = PbI2↓
2. Мы пронаблюдали движение окрашенных ионов под действием электрического тока. Для опыта взяли комплексную соль – хромат тетрааммино меди II. Соль имеет тёмно-зелёную окраску. Под действием электрического тока происходит движение ионов [Cu(NH3)4] CrO4→[Cu(NH3)4]2++CrO42-
зелёный синий жёлтый
К катоду движутся синие ионы [Cu(NH3)4]2+, к аноду – жёлтые CrO42-
1.4 Открытие новых химических элементов
Ещё один существенный момент, указывающий на значимость Периодической системы и Периодического закона – это открытие новых элементов. Первыми доказательствами гениальности открытия Менделеева было обнаружение новых элементов: экабора (скандия 1879 Л. Нильсон), экаалюминия (галлия 1875 П. Лекок де Буабодран) и экасилиция (германия 1886 г. Винклер К.), свойства которых он предсказал.
С начала XXI столетия только в нашей стране их было получено пять. По утверждению великого физика Нильса Бора, их не должно было быть более ста. И тем не менее, их уже известно сто восемнадцать! Скорее всего они когда-то существовали на Земле при надлежащих условиях. Большинство открытых элементов живут недолго, доли секунды и это затрудняет их изучение и использование. Но, по всей видимости, это нас ждёт впереди. По утверждению академика Оганесяна, открытий хватит и детям, и внукам. Открыты только «острова», впереди открытие «континента». (слайд 17)
Официально объявлено, что ИЮПАК по результатам работы совместного комитета Международного союза теоретической и прикладной химии и Международного союза теоретической и прикладной физики утвердил открытие новых химических элементов Периодической таблицы Д.И.Менделеева с атомными номерами 113, 115, 117 и 118. (6 янв. 2016 г.)
(слайд 18) Попыток открыть новые элементы было много. Первое заявление об открытии элементов 116 и 118 в 1999 году в Беркли (США) оказалось ошибочным и даже фальсифицированным. Использовалась реакция холодного слияния ядер
свинца и криптона: ![]()
Ядерная реакция 2015 года:
![]() (слайд 19)
(слайд 19)
Перспективы развития работ по синтезу СТЭ
На сегодня ОИЯИ является признанным мировым лидером в синтезе и изучении свойств новых Сверхтяжелых Элементов (СТЭ) Периодической таблицы Д.И.Менделеева. Однако научная конкуренция в данной области усиливается и сегодня. Соответствующие программы приняты в Германии, Японии, КНР, Франции и США. Дальнейшее развитие данных исследований ОИЯИ связывает с созданием первой в мире Фабрики Сверхтяжелых Элементов на базе нового самого мощного в данной области энергий ускорителя тяжелых ионов с интенсивностью в 10 раз превышающий достигнутой на сегодня, что позволит ставить задачи синтеза новых элементов с атомными номерами 119 и 120 и далее, т.е. первых элементов 8-го периода Периодической таблицы Д.И.Менделеева. Дальнейшее продвижение по Периодической таблице может привести к образованию совсем новой группы элементов — g-элементов (начиная с элемента 121) с интересными свойствами. Все эти вопросы еще ждут подробного исследования.
1.5 О Нобелевской премии
Работа уже близилась к концу, когда у нас возник вопрос: «Почему такое поистине великое открытие не было отмечено Нобелевской премией?» Нобелевская премия появилась ещё при жизни скромного гения и могла была быть вручена до 1907 года. Менделеев выдвигался на Нобелевскую премию, но не от Российской академии, а от Шведской, членом которой он так же был. Как это ни печально, но свои таланты у нас в стране недооценивали и при царе.
Яростным противником награждения Менделеева был нобелевский лауреат Сванте Аррениус. Он не мог простить критические публикации Менделеева по поводу его теории электролитической диссоциации. В общем, в мире большой науки далеко не все так идеально. Вопрос о присуждении премии Менделееву обсуждался в 1906, но Аррениус добился победы кандидатуры Муассана.
Обыкновенные человеческие пороки и страсти могут стать причиной незаслуженных оценок. Впрочем, проживи Менделеев дольше, премию он получил бы. Влияние недоброжелателей было бы не таким сильным.
1.6 Заключение
Периодический закон позволил предсказать свойства многих еще неоткрытых элементов. Предсказания Менделеева вскоре оправдались. Это был триумф теории. С его помощью, а также используя такие достижения физики, как открытия электрона и радиоактивности, Э. Резерфорд, Н. Бор и другие ученые предложили модель атома, разработали теорию строения атома, а затем и теорию химической, связи. Так была решена одна из центральных проблем химии: выяснение связи свойств с составом и строением тех объектов, которые она изучает. Периодический закон помог сделать новые открытия в других областях знаний, в биологии, например. Закон гомологических рядов в наследственной изменчивости — открытый русским генетиком Н.И. Вавиловым в 1920 г.- закономерность, устанавливающая параллелизм (сходство) в наследственной (генотипической) изменчивости у родственных организмов.
Даже мы в экспериментальной части работы обнаружили взаимосвязь двух открытий: Периодического закона и теории электролитической диссоциации С. Аррениуса.
Независимо от признания или непризнания в научных кругах, великое открытие не перестаёт быть великим. Это подтверждается открытием строения атома и всё новых и новых элементов.
Сбывается предсказание самого Дмитрия Ивановича:
«По видимости, Периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает» Д. И. Менделеев
1.7 Библиография
1. Ильченко В.Р. Перекрёстки физики, химии и биологии. - М.: Просвещение, 1986
2. Всеобщие законы развития. Материалистическая диалектика как общая теория развития: Философские основы теории развития. – М., 1982.
3. Я. Голованов. Этюды об учёных
4. Волков В.А., Вонский Е.В., Кузнецова Г.И. Выдающиеся химики мира. -- М.: ВШ, 1991. - 656 с.
5. Всеобщая история химии. Становление химии как науки. -- М.: Наука, 1983. - 464 с.
6. Петров Ю.А. Логическая функция категорий диалектики. – М., 1972.
7. http://iupac.org/
8. Менделеев Д. И. Заветные мысли Д. Менделеева. СПб., 1903-1905;
9. Семенченко В. К. Менделеев и физика атома. Пенза, 1945
1.8 Приложения
Первая публикация таблицы Менделеева Из истории открытия атома Угол отклонения частиц равен заряду ядра




«Нарушения» в таблице

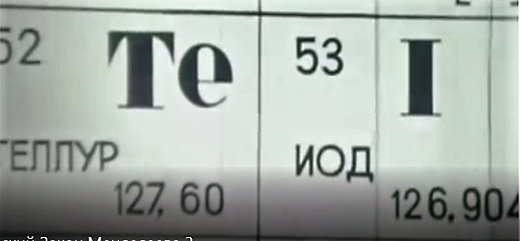

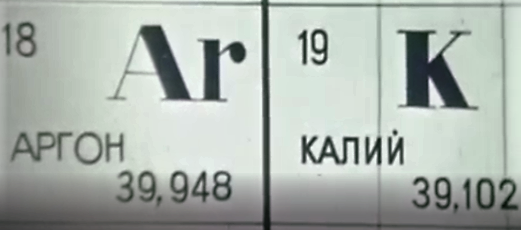
Иллюстрация к закону отрицания отрицания
Ритм – основа жизни всего живого и неживого
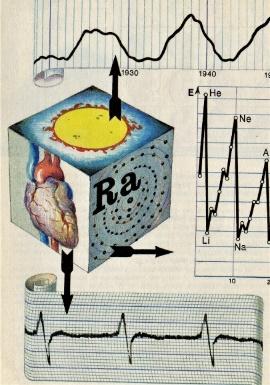
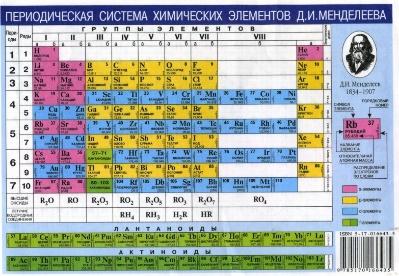 Таблица конца XX века
Таблица конца XX века
Иллюстрация к закону перехода количества в качество

Иллюстрация к закону единства и борьбы противоположностей


Один из последних вариантов Периодической таблицы. Юрий Оганесян

Характеристики Московия и Оганесона

Один из вариантов опыта
с движением окрашенных ионов

3

 Получите свидетельство
Получите свидетельство Вход
Вход












 Закон химической гармонии (2.2 MB)
Закон химической гармонии (2.2 MB)
 0
0 527
527 9
9 Нравится
0
Нравится
0


