Темa: Електропровідність електролітів. Закони Фарадея. Застосування електролізу.
Мета: роз’яснити учням фізичну природу електропровідності рідких провідників, навчити учнів застосовувати закон електролізу Фарадея під час розв'язування задач, ознайомити з технічним застосуванням електролізу.
Тип уроку: пояснення нового матеріалу.
Обладнання: розчин мідного купоросу, два електроди, джерело живлення, роздатковий матеріал, довідковий матеріал.
План уроку.
І Організаційний момент.
1.Облік. Перевірка домашнього завдання
2.Повідомлення теми і мети уроку.
ІІ Актуалізація розумової діяльності учнів
1.Що є носіями струму в металах?
2.Як називаються електрони, які відірвалися від атомів?
3.Записати формулу, яка пов’язує швидкість впорядкованого руху електронів в металі із силою струму.
4.Сформулювати положення класичної електронної теорії провідності металів.
5.Як залежить опір металевих провідників від температури?
6.Що таке надпровідність?
ІІІ Пояснення нового матеріалу
План викладення нового матеріалу:
1. Електролітична дисоціація.
2. Електроліз.
3. Технічне застосування електролізу
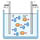
1. Електролітична дисоціація. Як відомо, провідниками електричного струму можуть бути не тільки тверді тіла, але й рідини. Досліди показують, що електроліти (розчини солей, кислот і лугів у воді) є гарними провідниками електричного струму.
Процес розпаду молекул розчиненої речовини на іони під дією розчинника називається електролітичною дисоціацією.
Молекули речовин, що розчиняються, складаються із взаємозв'язаних іонів протилежних знаків (наприклад Na+Cl-, Н+ Cl-, К+ Cl-, Сu++SO4--). Сили тяжіння між іонами забезпечують цілісність таких молекул. Взаємодія цих молекул із полярними молекулами розчинника, наприклад води, приводить до послаблення взаємного тяжіння протилежно заряджених іонів. Із збільшенням температури ступінь дисоціації зростає, і, отже, збільшується концентрація позитивно й негативно заряджених іонів.
У розчині може відбуватися також і процес, що називають рекомбінацією. Рекомбінація — процес об'єднання іонів у нейтральні молекули.
Між процесами електролітичної дисоціації й рекомбінації іонів за незмінних умов встановлюється динамічна рівновага, коли число молекул, що розпадаються на іони в одиницю часу, дорівнює числу пар іонів, які за цей час об'єднуються в нейтральні молекули.
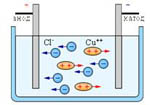
Іони в електролітах рухаються хаотично до тих пір, поки в рідину не опускаються електроди (катод і анод). Тоді на хаотичний рух іонів накладається їx впорядкований рух до відповідних електродів і в рідині виникає електричний струм:

2. Електроліз. За іонної провідності проходження струму пов'язане з перенесенням речовини. На електродах відбувається виділення речовин, що входять до складу електролітів.
Процес виділення речовини на електродах під час проходження електричного струму через електроліт називається електролізом.
На аноді негативно заряджені іони віддають свої зайві електрони (в хімії цей процес називається окисною реакцією), а на катоді позитивні іони дістають електрони, яких їм бракує (відновна реакція).
Розглянемо відеофрагмент, в якому можна побачити явище електролізу на молекулярному рівні
Закон електролізу. Кожний іон, який у процесі електролізу нейтралізується на електроді й виділяється на ньому у вигляді нейтрального атома, має певну масу. Але разом із тим він переносить через електроліт певний заряд. Тому й маса речовини, що виділилася, й кількість електрики, що пройшла, пропорційні числу іонів, які підходять до даного електрода.
Маса речовини, що виділилася m = mіN , де mі — маса іона, N — число іонів, що нейтралізуються на даному електроді.
Масу іона можна визначити як , де М — молярна маса, a NA — стала Авогадро. Тоді
, де М — молярна маса, a NA — стала Авогадро. Тоді

Число іонів N, які проходять крізь розчин електроліту до даного електроду, можна знайти таким чином: кожний одновалентний іон несе заряд, який дорівнює заряду електрона є або, якщо валентність іона дорівнює n, кратний йому en. Уся кількість електрики, яка переноситься N іонами, — q = neN ,звідси тоді
тоді
Позначимо через k коефіцієнт пропорційності між масою речовини й зарядом:
Тоді остаточно дістаємо закон електролізу Фарадея: m = kq.
Маса речовини, що виділилася на електроді під час проходження електричного струму, пропорційна кількості електрики, що пройшла через розчин.
Коефіцієнт k називається електрохімічним еквівалентом даної речовини. Значення цього коефіцієнта можна з'ясувати з виразу:


Електрохімічний еквівалент чисельно дорівнює масі речовини в кілограмах (кг), що виділяється під час проходження 1 Кл електрики.
Коефіцієнт k залежить від молярної маси речовини й валентності. Отже, електрохімічні еквіваленти неоднакові не тільки для різних речовин, але й для однієї й тієї самої речовини в різних сполуках, у яких воно має різну валентність (наприклад CuCl і CuSO4 ).
Другий закон електролізу: електрохімічний еквівалент речовини пропорційний їх хімічному еквіваленту: 
 , де М – молярна маса, F – стала Фарадея,
, де М – молярна маса, F – стала Фарадея,
F = 9,65·107 Кл/кг = 96500 Кл/моль.
 - об’єднаний закон електролізу Фарадея.
- об’єднаний закон електролізу Фарадея.
3. Технічне застосування електролізу.
• Гальванотехніка:
а) гальваностегія — покриття деталей тонким шаром металу (золочення, нікелювання, хромування тощо);
б) гальванопластика — відкладення товстого шару металу, який відшаровується й використовується самостійно (отримання матриць для друкарських пластинок, барельєфів тощо).
• Електрометалургія — виділення чистих металів із природних сумішей (мідь із мідного колчедану, алюмінію з розплавленого бокситу, срібло з відходів фото виробництва).
• Очистка металевих деталей (деталь є анодом).
ІV Закріплення
1. Що є носіями електричного струму в електролітах?
2. Чому під час проходження струму по розчину електроліту відбувається перенесення речовини, а під час проходження струму по металевому провіднику — не відбувається?
3. Чи залежить кількість виділеної на електродах під час електролізу речовини від концентрації розчину, якщо крізь розчин проходить однакова кількість електрики?
Розв'язання задач
Задача 1 (роздатковий матеріал). При пропусканні через електроліт струму 1,5 А за 5 хв на катоді виділилось 137 мг речовини. Що це за речовина?
Задача 2 1. Сталеві деталі покриваються двовалентним нікелем у електролітичній ванні при густині сили струму 400А/м. Скільки потрібно часу, щоб на деталі утворився шар нікелю завтовшки 60мкм?
Розв’язання

 ,
, 
2-й спосіб:
Використавши табличне значення електрохімічного еквівалента нікелю і 1-й закон електролізу, отримаємо:


Задача 3. За час електролізу розчину HCl на аноді виділилося 35г хлору. Скільки водню виділиться на катоді за цей самий час?

Q-заряд. Звідси видно:  або
або

Для конспекту учня
¦Електроліти — це водні розчини солей, кислот і лугів.
¦ Процес розпаду молекул розчиненої речовини на іони під дією розчинника називається електролітичною дисоціацією.
¦ Процес об’єднання іонів у нейтральні молекули називається рекомбінацією.
¦ Процес виділення речовини на електродах під час проходження електричного струму через електроліт називається електролізом.
¦ Закон електролізу Фарадея:
маса речовини, що виділилася на електроді під час проходження електричного струму, пропорційна кількості електрики, що пройшла через розчин: m = kq.
V Підсумки уроку
Виставлення оцінок
VІ Домашнє завдання
Задачі
. При нікелюванні виробу протягом 1,5 год на ньому утворився шар нікелю завтовшки 0,03мм. Визначити середнє значення густини струму.
Відповідь: ј=163А/м.
5. Визначити товщину осадженого шару нікелю, якщо електроліз триває 1 год при густині струму 0,4А/дм2.
Відповідь:0,0005мм.
6. При електролізі розчину сірчаної кислоти за 50 хв виділилося 0,510-3кг водню. Визначити потужність, яка витрачається на нагрівання електролізу, якщо його опір 0,40м.
Відповідь: Р=36,6Вт.

 Получите свидетельство
Получите свидетельство Вход
Вход















 Урок физики "Електричний струм у рідинах" (0.22 MB)
Урок физики "Електричний струм у рідинах" (0.22 MB)
 0
0 1724
1724 310
310 Нравится
0
Нравится
0