
ОГЭ ХИМИЯ. ЗАДАНИЯ ПЕРВОЙ ЧАСТИ

Задание 1. Атомы и молекулы. Химический элемент. Простые и сложные вещества
Химический элемент — это определённый вид атомов. Атомы химического элемента могут входить в состав простых и сложных веществ. Можно охарактеризовать распространённость и формы нахождения химического элемента в природе, а также свойства его атомов (массу, размеры, строение).
Свойства химического элемента:
- Атомные характеристики (протоны, электроны, нейтроны, атомная масса и т.д.), групповая принадлежность (например, VII гр. – это галогены, VIII гр.- это инертные газы, I гр. – это щелочные металлы и т.д.), изотопы.
- Входит в состав чего-то (вещества в виде атомов, удобрений, сложных веществ, лекарственых препаратов, живых организмов и т.д.), но НЕ СМЕСИ.
- Биологическая роль в организме.
- … в состав молекулы входят…
- … образует несколько аллотропных модификаций.

Задание 1. Атомы и молекулы. Химический элемент. Простые и сложные вещества
Простое вещество образовано атомами одного химического элемента. Это одна из форм существования химического элемента в природе. Простое вещество характеризуется определённым составом, строением, физическими и химическими свойствами. Его применяют для получения других веществ.
Свойства простого вещества:
- Металл или неметалл.
- Химические свойства (горение, окисление, восстановление, реакции с другими веществами и т.д.).
- Физические свойства (температура плавления и кипения, плотность и т.д.)
- Применение.
- … имеет несколько аллотропных модификаций.
- Входит в состав смесей.

Задание 2. Строение атома. Строение электронных оболочек атомов
Строение атома: ядро (протоны и нейтроны) + электроны.
Число протонов (p + ) = порядковый номер химического элемента (Z).
Число нейтронов (n 0 ) = атомная масса - число протонов.
Число электронов (е - ) = порядковый номер химического элемента (Z).
Номер периода показывает число электронных слоев в электронной оболочке атома.
Номер группы показывает число электронов на внешнем электронном слое атома и число валентных электронов .
Каждый энергетический уровень делится на подуровни. На первом уровне только один подуровень - s. На втором уровне два подуровня - s и p. на третьем - s, p и d. На четвертом - s, p, d и f.
2 - максимальное число электронов на s-подуровне.
6 - максимальное число электронов на p-подуровне.
10 - максимальное число электронов на d-подуровне.
14 - максимальное число электронов на f-подуровне.
Заполнение энергетических уровней
1s
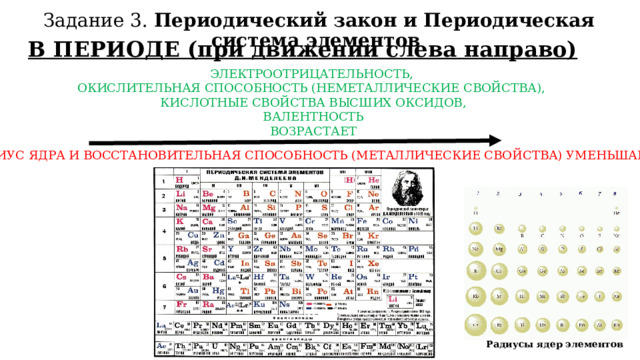
Задание 3. Периодический закон и Периодическая система элементов
В ПЕРИОДЕ (при движении слева направо)
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ,
ОКИСЛИТЕЛЬНАЯ СПОСОБНОСТЬ (НЕМЕТАЛЛИЧЕСКИЕ СВОЙСТВА),
КИСЛОТНЫЕ СВОЙСТВА ВЫСШИХ ОКСИДОВ,
ВАЛЕНТНОСТЬ
ВОЗРАСТАЕТ
РАДИУС ЯДРА И ВОССТАНОВИТЕЛЬНАЯ СПОСОБНОСТЬ (МЕТАЛЛИЧЕСКИЕ СВОЙСТВА) УМЕНЬШАЕТСЯ
Радиусы ядер элементов
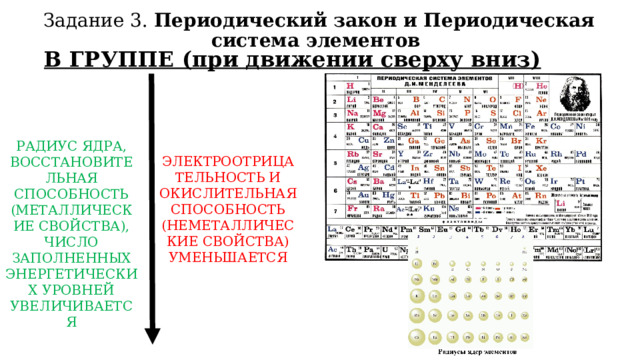
Задание 3. Периодический закон и Периодическая система элементов
В ГРУППЕ (при движении сверху вниз)
РАДИУС ЯДРА,
ВОССТАНОВИТЕЛЬНАЯ СПОСОБНОСТЬ (МЕТАЛЛИЧЕСКИЕ СВОЙСТВА),
ЧИСЛО ЗАПОЛНЕННЫХ ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ
УВЕЛИЧИВАЕТСЯ
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ И ОКИСЛИТЕЛЬНАЯ СПОСОБНОСТЬ (НЕМЕТАЛЛИЧЕСКИЕ СВОЙСТВА) УМЕНЬШАЕТСЯ

Задание 4: Валентность и степень окисления химических элементов
Степень окисления
- Степень окисления простых веществ и свободных атомов всегда равна нулю (0).
- У металлов степень окисления всегда положительна и равна номеру группы (для металлов главных подгрупп).
- У атома водорода степень окисления равна +1 (Исключение - соединения с металлами (гидриды) - с.о. = -1).
- У атома кислорода (О) в соединениях степень окисления равна -2, кроме соединений со фтором (+2).
- Степень окисления фтора (F) в соединениях всегда равна -1.
- Суммарная степень окисления в молекуле всегда равна 0.
- Степень окисления некоторых элементов можно определить по таблице растворимости.

Задание 5: Строение молекул. Химическая связь
Ковалентная неполярная связь образуется в молекулах между атомами одного элемента-неметалла. (ДВА ОДИНАКОВЫХ НЕМЕТАЛЛА)
Ковалентная полярная связь присутствует в молекулах между атомами разных неметаллов. (ДВА РАЗНЫХ НЕМЕТАЛЛА)
Металлическая связь присуща металлам. (В МЕТАЛЛЕ)
Ионная — между атомами металлов и неметаллов. (МЕТАЛЛ + НЕМЕТАЛЛ)
Водородная присутствует между молекулами соединений, содержащих атом водорода, связанный с атомом с высокой электроотрицательностью (F, O, N). (ВОДОРОД + НЕМЕТАЛЛ)

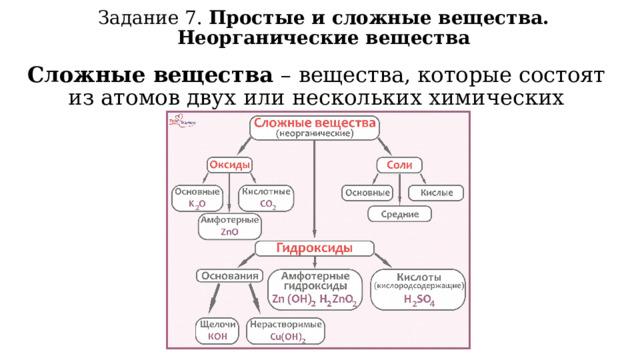
Задание 7. Простые и сложные вещества. Неорганические вещества
Простые вещества – вещества, образованные атомами одного химического элемента.
Простые вещества делят на металлы и неметаллы .
Щелочные металлы – металлы 1 группы главной подгруппы: Li, Na, K, Rb, Cs, Fr.
Щелочноземельные металлы – металлы 2 группы главной подгруппы: Be, Mg, Ca, Sr, Ba, Ra.
Переходные металлы – металлы побочных подгрупп.
Галогены – элементы главной подгруппы 7 группы: F 2 , Cl 2 , Br 2 , I 2 , At 2 , Ts.
Благородные газы (инертные газы) – элементы восьмой группы: He, Ne, Ar, Kr, Xe, Rn, Og.

Задание 7. Простые и сложные вещества. Неорганические вещества
Сложные вещества – вещества, которые состоят из атомов двух или нескольких химических элементов.
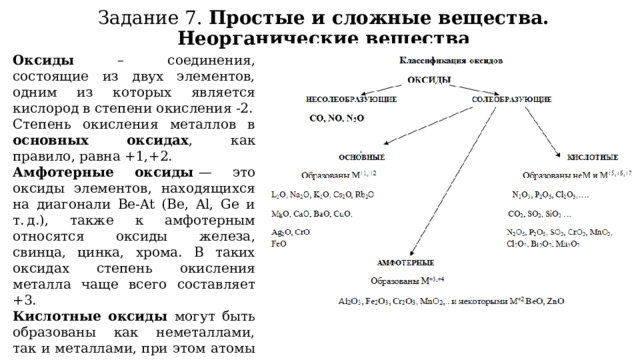
Задание 7. Простые и сложные вещества. Неорганические вещества
Оксиды – соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.
Степень окисления металлов в основных оксидах , как правило, равна +1,+2.
Амфотерные оксиды — это оксиды элементов, находящихся на диагонали Be-At (Be, Al, Ge и т. д.), также к амфотерным относятся оксиды железа, свинца, цинка, хрома. В таких оксидах степень окисления металла чаще всего составляет +3.
Кислотные оксиды могут быть образованы как неметаллами, так и металлами, при этом атомы металлов, входящих в состав кислотных оксидов, имеют высокую степень окисления (+4, +5,+6,+7).
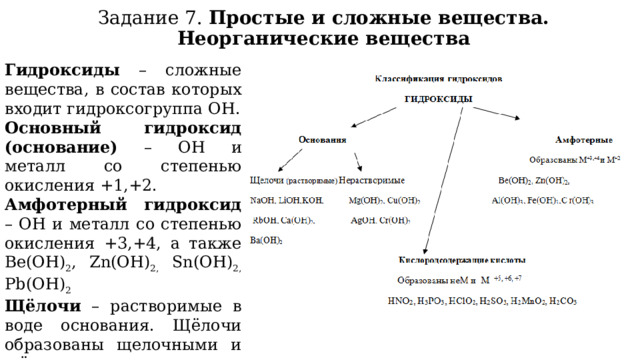
Задание 7. Простые и сложные вещества. Неорганические вещества
Гидроксиды – сложные вещества, в состав которых входит гидроксогруппа ОН.
Основный гидроксид (основание) – ОН и металл со степенью окисления +1,+2.
Амфотерный гидроксид – ОН и металл со степенью окисления +3,+4, а также Be(OH) 2 , Zn(OH) 2, Sn(OH) 2, Pb(OH) 2
Щёлочи – растворимые в воде основания. Щёлочи образованы щелочными и щёлочноземельными металлами.
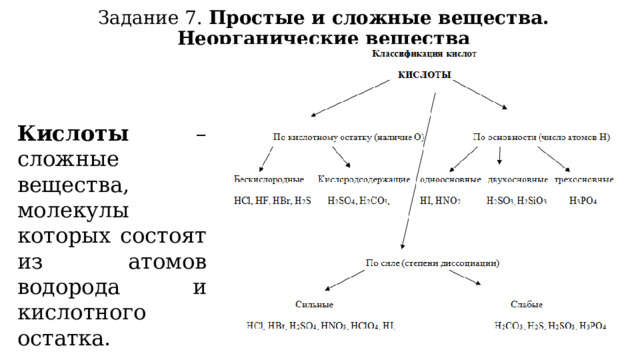
Задание 7. Простые и сложные вещества. Неорганические вещества
Кислоты – сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
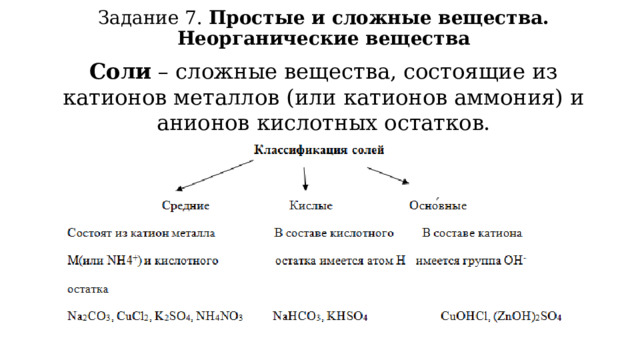
Задание 7. Простые и сложные вещества. Неорганические вещества
Соли – сложные вещества, состоящие из катионов металлов (или катионов аммония) и анионов кислотных остатков.

Задание 8. Химические свойства простых веществ. Химические свойства оксидов
Химические свойства основных оксидов:
- Основный оксид + вода → щелочь .
Na 2 O + H 2 O → 2NaOH
CaO + H 2 O → Ca(OH) 2
2. Основный оксид + сильная кислота (HCl, HBr, H 2 SO 4 , HNO 3 ,HClO 4 , HI) → соль + вода : CaO + H 2 SO 4 → CaSO 4 + H 2 O.
3. Основный оксид + H 2 → металл + вода .
AgOH + H 2 → Ag + H 2 O 3. Основный оксид + кислотный оксид → соль : СaO + SiO 2 → CaSiO 3
4. Основный оксид + амфотерный оксид → соль : СaO + Al 2 O 3 → Сa(AlO 2 ) 2

Задание 8. Химические свойства простых веществ. Химические свойства оксидов
Химические свойства кислотных оксидов:
1. Кислотный оксид + вода → кислота
Условия протекания реакции: должна образовываться растворимая кислота .
P 2 O 5 + 3H 2 O → 2H 3 PO 4 2. Кислотный оксид + соль → новая соль + летучий оксид (CO 2 , NO 2 , SO 2 , ClO 2 ).
CaCO 3 + SiO 2 = CaSiO 3 + CO 2
3. Кислотный оксид + щелочь → соль + вода .
SO 3 + 2NaOH → Na 2 SO 4 + H 2 O
4. Кислотный оксид + основный оксид → соль SO 3 + Na 2 O → Na 2 SO 4 5. Оксид + O 2 → оксид с более высокой степенью окисления .
2СО + О 2 → 2СО 2
2SO2 + O 2 ⇆ 2SO 3
![Задание 8. Химические свойства простых веществ. Химические свойства оксидов Химические свойства амфотерных оксидов 1.Амфотерный оксид + кислота/кислотный оксид → соль + вода (с оксидами только соль). ZnO + H 2 SO 4 → ZnSO 4 + H 2 O ZnO + SiO 2 → ZnSiO 3 2. Амфотерный оксид + основный оксид → соль . Al 2 O 3 + CaO → Ca(AlO 2 ) 2 3. Амфотерный оксид + щелочь → комплексная соль/обычная соль и вода ZnO + 2NaOH + H 2 O = Na 2 [Zn(OH) 4 ] Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O 4. Не реагируют с водой.](https://fsd.videouroki.net/html/2024/04/24/v_6628eb61ef09c/img17.jpg)
Задание 8. Химические свойства простых веществ. Химические свойства оксидов
Химические свойства амфотерных оксидов
1.Амфотерный оксид + кислота/кислотный оксид → соль + вода (с оксидами только соль).
ZnO + H 2 SO 4 → ZnSO 4 + H 2 O
ZnO + SiO 2 → ZnSiO 3 2. Амфотерный оксид + основный оксид → соль . Al 2 O 3 + CaO → Ca(AlO 2 ) 2
3. Амфотерный оксид + щелочь → комплексная соль/обычная соль и вода
ZnO + 2NaOH + H 2 O = Na 2 [Zn(OH) 4 ]
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
4. Не реагируют с водой.
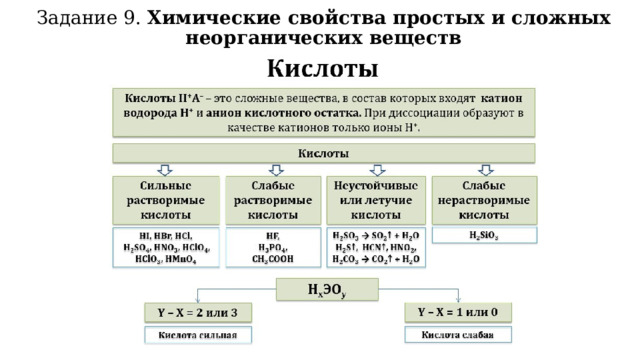
Задание 9. Химические свойства простых и сложных неорганических веществ

Задание 9. Химические свойства простых и сложных неорганических веществ
Химические свойства кислот
1. Кислота + основный/амфотерный оксид – соль + вода .
K 2 O + HNO 3 = KNO 3 + H 2 O
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O
2. Кислота + основный/амфотерный гидроксид – соль + вода
KOН + HNO 3 = KNO 3 + H 2 O
Al(OН) 3 + 3HCl = AlCl 3 + 3H 2 O
3. Кислота + щелочь – кислая/средняя соль + вода .
NaOH + H 3 PO 4 → NaH 2 PO 4 + H 2 O
3NaOH + H 3 PO 4 → Na 3 PO 4 + 3H 2 O

Задание 9. Химические свойства простых и сложных неорганических веществ
4. Кислота + металл (левее H в ряду активности металлов) – растворимая соль + H 2
Mg + 2HCl = MgCl 2 + H 2 ↑
Азотная кислота любой концентрации и серная концентрированная кислота при взаимодействии с металлами водород не образуют.
Азотная кислота + металл = соль металла + продукт восстановления азота (NO 2 , NО, N 2 O, N 2 , NH 4 NO 3 ) + H 2 O
Cu + 4HNO 3(конц) = Cu(NO 3 ) 2 + 2NO 2 ↑ + H 2 O
H 2 SO 4 (конц) + металл = соль металла + продукт восстановления серы (SO 2 , S, H 2 S) + вода
Cu + 2H 2 SO 4(конц) = CuSO 4 + SO 2 ↑ + H 2 O
5. Кислота + растворимая соль → соль + оксид и вода .
CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2
Кислота + нерастворимая соль → соль + кислота .
CaS+ 2HCl → CaCl+ HS
CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2
H 2 CO 3 – уксусная кислота, которая сразу разлагается на CO 2 и H 2 O
Более сильные кислоты вытесняют менее сильные кислоты из солей.

Задание 10. Химические свойства простых и сложных веществ
Основания – сложные вещества, в состав которых входят металлические химические элементы, соединённые с одной или несколькими гидроксогруппами (группами атомов −OH).
Химические свойства нерастворимых оснований
1. Основание + кислота/кислотный оксид – соль + вода .
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
2. Основание (нагревание) – оксид + вода .
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
3. Не взаимодействуют с амфотерными оксидами и гидроксидами .
![Задание 10. Химические свойства простых и сложных веществ Химические свойства щелочей: 1. Щелочь + кислота/кислотный оксид – соль + вода 3NaOH + H 3 PO 4 → Na 3 PO 4 + 3H 2 O 2NaOH + CO 2 = Na 2 CO 3 + H 2 O 2. Щелочь + растворимая соль – нерастворимая соль + щелочь / соль + нерастворимое основание ZnSO 4 + 2KOH = Zn(OH) 2 ↓ + K 2 SO 4 3. Щелочь (расплав) + амфотерный оксид/амфотерный гидроксид – средняя соль (катион – металл, анион – амфотерный оксид и O) + вода. NaOH + Al(OH) 3 = NaAlO 2 + 2H 2 O Щелочь (раствор) + амфотерный оксид/амфотерный гидроксид – комплексная соль NaOH + Al(OH) 3 = Na[Al(OH) 4 ] 4. Щелочь + металл – комплексная соль + Н 2 2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2 5. Щелочь + неметалл (S, Cl, Br, I, P) – соль + средняя соль + вода . 2NaOH +Cl 2 0 = NaCl — + NaOCl + + H 2 O](https://fsd.videouroki.net/html/2024/04/24/v_6628eb61ef09c/img22.jpg)
Задание 10. Химические свойства простых и сложных веществ
Химические свойства щелочей:
1. Щелочь + кислота/кислотный оксид – соль + вода
3NaOH + H 3 PO 4 → Na 3 PO 4 + 3H 2 O
2NaOH + CO 2 = Na 2 CO 3 + H 2 O
2. Щелочь + растворимая соль – нерастворимая соль + щелочь / соль + нерастворимое основание
ZnSO 4 + 2KOH = Zn(OH) 2 ↓ + K 2 SO 4
3. Щелочь (расплав) + амфотерный оксид/амфотерный гидроксид – средняя соль (катион – металл, анион – амфотерный оксид и O) + вода.
NaOH + Al(OH) 3 = NaAlO 2 + 2H 2 O
Щелочь (раствор) + амфотерный оксид/амфотерный гидроксид – комплексная соль
NaOH + Al(OH) 3 = Na[Al(OH) 4 ]
4. Щелочь + металл – комплексная соль + Н 2
2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2
5. Щелочь + неметалл (S, Cl, Br, I, P) – соль + средняя соль + вода .
2NaOH +Cl 2 0 = NaCl — + NaOCl + + H 2 O
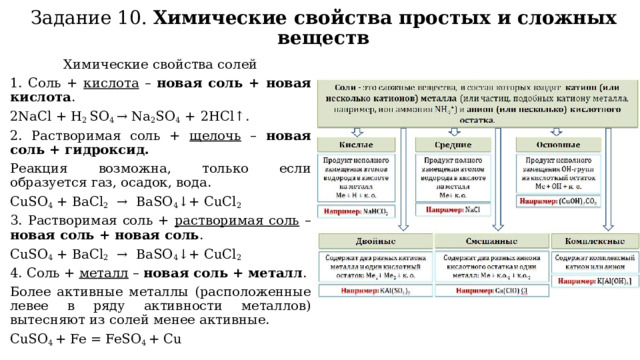
Задание 10. Химические свойства простых и сложных веществ
Химические свойства солей
1. Соль + кислота – новая соль + новая кислота .
2NaCl + H 2 SO 4 → Na 2 SO 4 + 2HCl↑.
2. Растворимая соль + щелочь – новая соль + гидроксид.
Реакция возможна, только если образуется газ, осадок, вода.
CuSO 4 + BaCl 2 → BaSO 4 ↓+ CuCl 2
3. Растворимая соль + растворимая соль – новая соль + новая соль .
CuSO 4 + BaCl 2 → BaSO 4 ↓+ CuCl 2
4. Соль + металл – новая соль + металл .
Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
CuSO 4 + Fe = FeSO 4 + Cu

Задание 10. Химические свойства простых и сложных веществ
Химические свойства неметаллов:
1.Для неметаллов характерны реакции с металлами:
- Металл + водород – гидриды .
2Na + H 2 → 2NaH
- Металл + хлор – хлориды
3Cl 2 + 2Fe → 2FeCl 3
- Металл + кислород – оксиды .
2Ca + O 2 → 2CaO
- Металл + сера – сульфиды .
S + Fe → FeS
- Металл + фосфор – фосфиды .
2P + 3Ca → Ca 3 P 2
- Металл + углерод – карбиды .
4C + 3Al → Al 4 C 3
2. Реакции с другими неметаллами:
- Неметалл + кислород (кроме фосфора) – оксид
S + O 2 → SO 2
- Неметаллы могут вступать в реакции с другими неметаллами. При этом более электроотрицательный неметалл играет роль окислителя , менее электроотрицательный – роль восстановителя .
S + 3F 2 → SF 6
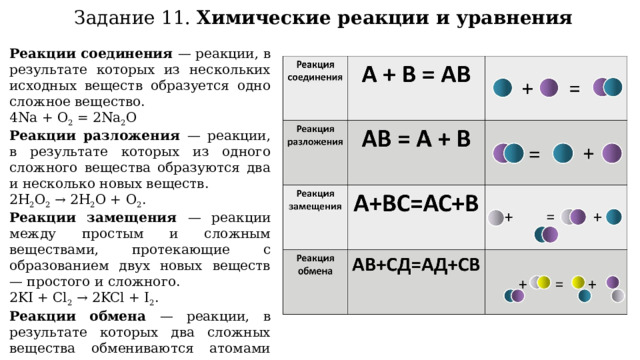
Задание 11. Химические реакции и уравнения
Реакции соединения — реакции, в результате которых из нескольких исходных веществ образуется одно сложное вещество.
4Na + O 2 = 2Na 2 O
Реакции разложения — реакции, в результате которых из одного сложного вещества образуются два и несколько новых веществ.
2H 2 O 2 → 2H 2 O + O 2 .
Реакции замещения — реакции между простым и сложным веществами, протекающие с образованием двух новых веществ — простого и сложного.
2KI + Cl 2 → 2KCl + I 2 .
Реакции обмена — реакции, в результате которых два сложных вещества обмениваются атомами или группами атомов.
NaOH + HCl = NaCl + H 2 O

Задание 12. Условия и признаки протекания химических реакций
Осадки белого цвета образуют практически все нерастворимые соединения Ca, Ba, Mg, Al, Zn, Be, Pb. Ag.
Осадки белые, мелкокристаллические - CaCO3 , ВaCO3 , MgCO3 , PbCO3
Са3(РО4)2 , Ва3(РО4)2 , Mg 3(РО4)2, ВaSO4,, Li3РО4, Li2SiO3, Pb SO4, ZnS
Осадок белый, творожистый – AgCl (PbCl2 )
Осадки белые, объемные - Mg(OH)2, Zn(OH)2, Be(OH)2, Al(OH)3
Осадок светло-желтый, творожистый – AgBr (PbBr2 )
Осадок светло-желтый, мелкокристаллический - Ag2CO3
Осадок желтый, творожистый – AgI, (PbI2)
Осадок желтый, мелкокристаллический – Ag3РО4
Осадок голубого цвета – Cu(OH)2
Осадки черного цвета – CuS, Ag2S, PbS
Осадок зеленого цвета, постепенно буреющий – Fe(OH)2

Задание 12. Условия и признаки протекания химических реакций
Осадки бурого цвета – Ag2О, Fe(OH) 3
Осадок студенистый, бесцветный - H2SiO3
Осадки, растворимые в кислотах с образованием прозрачных растворов - Mg(OH)2 ,Cu(OH)2 , Fe(OH)2 , Fe(OH)3, Ag3РО4 , Li3РО4
Осадки, растворимые в кислотах с выделением газа - CaCO3 , ВaCO3 , MgCO3 , . PbCO3 , Ag2CO3, CuS, Ag2S , PbS.
Осадки, растворимые в кислотах и щелочах с образованием прозрачных растворов - Zn(OH)2 , Be(OH)2 , Al(OH)3
Газы без цвета и запаха, неядовитые – О2 , H2. CO2, N2
Газы без цвета с резким запахом, ядовитые - NH3 (запах нашатырного спирта), H2S (запах тухлых яиц), SO2 (резкий кислый запах). Остальные описываем как газы с неприятным запахом - NO, N2О
Газы окрашенные, с неприятным запахом, ядовитые - NO2 (бурый газ), Cl2 (желто – зеленый газ с запахом хлорки), О3 ( газ синего цвета с резким запахом)
Газ без цвета и запаха, ядовитый – CO (угарный газ)
Газы растворимые в воде - HCl, CO2, NH3, H2S, SO2 , NO2
Газ, поддерживающий горение (вспыхивает тлеющая лучинка) - О2
Газ, сгорающий с характерным хлопком - H2.
Газ, вызывающий помутнение известковой или баритовой воды, выделяется с характерным шипением - CO2

Задание 12. Условия и признаки протекания химических реакций
превращение гидроксида железа (II) в гидроксид железа (III) ( цвет меняется с зеленого на бурый );
оксида меди (II) в растворимые соли меди (II) ( цвет меняется с черного на голубой , хлорид меди зеленого цвета!);
гидроксида меди (II) в оксид меди (II) ( цвет меняется с голубого на черный ).
https://distant-lessons.ru/tablicy-kachestvennyx-reakcij.html

Задание 13. Условия и признаки протекания химических реакций
Электролитическая диссоциация — процесс распада электролита на ионы (положительные – катионы, отрицательные – анионы) при его растворении или плавлении. HCl ↔H+ + Cl-
Сильные электролиты – это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4, HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2).
Слабые электролиты – вещества, частично диссоциирующие на ионы.
Неэлектролиты — вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи. К ним относятся все простые вещества , оксиды неметаллов, органические соединения .

Задание 13. Условия и признаки протекания химических реакций
Кислоты диссоциируют на катионы водорода и анионы кислотного остатка:
HNO 3 = H + + NO 3 ˉ
Многоосновные кислоты диссоциируют ступенчато:
1 ступень H 2 CO 3 ↔ H + + HCO 3 –
2 ступень HCO 3 – ↔ H + + CO 3 2–
Щёлочи диссоциируют на катионы металла и гидроксид-ионы.
Соли диссоциируют на катионы металла или аммония и анионы кислотного остатка
Na 3 PO 4 → 3Na + +PO 4 3-
Кислые соли распадаются ступенчато. На первом этапе отделяются катионы металла, а на втором — катионы водорода.
KHSO 4 = K + + HSO 4 2-
HSO4 ⇄ H + + SO 4 2-
Основные соли также диссоциируют в две ступени. На первой отделяются кислотные остатки, а за ними — гидроксильные группы OH - .
MgOHBr = MgOH + + Br -
MgOH + ⇄ Mg 2+ + OH -

Задание 13. Условия и признаки протекания химических реакций
При полной диссоциации 1 моль каких двух из представленных веществ образуется 1 моль катионов и 1 моль анионов?
1) фосфат натрия; 2) хлорид бария; 3) нитрат натрия; 4) сульфид меди; 5) бромид калия.
Решение:
Составляем уравнения диссоциации для каждого вещества. Считаем количество ионов, которые образовались в процессе диссоциации.
Сильные электролиты сразу же распадаются на ионы. Слабые электролиты распадаются на ионы в несколько ступеней и обратимо. Неэлектролиты не подвержены диссоциации.
Na 3 PO 4 ↔3Na + PO 4 - 3 катиона, 1 анион;
BaCl 2 ↔Ba 2 + 2Cl - 1 катион, 2 аниона;
NaNO3 ↔Na + NO 3 - 1 катион, 1 анион ;
CuS – нерастворимое вещество, в растворе практически нет ионов;
KBr ↔K + Br - 1 катион, 1 анион .
Ответ: 3,5.

Задание 14. Реакции ионного обмена и условия их осуществления
Ионные реакции возможны только в том случае, если между ионами происходит химическое взаимодействие, т. е. какие-либо ионы одного электролита и какие-либо ионы другого электролита связываются друг с другом и образуют:
- нерастворимое вещество, выпадающее в виде осадка;
- газообразное вещество;
- молекулы малодиссоциирующего вещества (слабого электролита) – вода, органические вещества, NH 3 .
На ионы не расписывают :
- Воду;
- Слабые кислоты;
- Трудно растворимые кислоты, основания, соли.
- Газообразные соединения;
- Оксиды.
Если в ходе реакции выпадает осадок, то рядом с формулой вещества (справа) его обозначают в виде стрелки, направленной вниз (↓).
Если в ходе реакции выделяется газообразное вещество, то рядом с формулой вещества (справа) его обозначают в виде стрелки, направленной вверх (↑).

Задания 15. Окислительно-восстановительные реакции
Окисление – процесс отдачи электронов.
Восстановление – процесс присоединения электронов.
Восстановители – частицы (атомы, ионы, молекулы), которые отдают электроны.
Окислители – частицы (атомы, ионы, молекулы), которые принимают электроны.
ОКИСЛИТЕЛЬ
ВОССТАНОВИТЕЛЬ
получает электроны окисляет восстанавливается понижает свою степень окисления
отдает электроны восстанавливает окисляется повышает свою степень окисления

Задания 18. Вычисление массовой доли химического элемента в веществе
Первым делом записываем формулу вещества, которое указано в задаче.
Для того, чтобы вычислить массовую долю химического элемента в веществе, необходимо воспользоваться формулой.
w – массовая доля элемента.
n – число атомов элемента в химическом соединении; Ar — относительная атомная масса элемента Э; Mr — относительная молекулярная масса химического соединения.
Пример: Вычислите в процентах массовую долю серы в сульфате железа(III). Запишите число с точностью до целых.
Fe₂(SО₄)₃ - сульфат железа(III).
Находим Mr (Fe₂(SО₄)₃) = Ar(Fe)*2 + Ar(S)*3 + Ar(O) * 12 = 56*2+32*3+16*12= 400
w (Fe) = 56*2/400 = 112/400 = 0,28 = 28%

ЛЕТУЧИЕ ВОДОРОДНЫЕ СОЕДИНЕНИЯ
Летучие водородные соединения – это соединения неметаллов с водородом.
CH 4 – Метан (бесцветный газ без вкуса и запаха)
SiH 4 – Силан (бесцветный газ с неприятным запахом)
NH 3 – Аммиак (бесцветный газ с резким запахом)
PH 3 – Фосфин (бесцветный газ с запахом гнилой рыбы, ядовит)
H 2 S – Сероводород (бесцветный газ с запахом тухлых яиц, ядовит)
HF – Фтороводород (бесцветный токсичный газ с резким неприятным запахом)
HCl – Хлороводород (бесцветный ядовитый газ с резким запахом)
HBr – Бромоводород (бесцветный ядовитый газ с резким запахом, сильно дымящийся на воздухе)
HI – Йодоводород (бесцветный удушливый газ, сильно дымит на воздухе)

 Получите свидетельство
Получите свидетельство Вход
Вход












 Теория для заданий первой части ОГЭ по химии (6.08 MB)
Теория для заданий первой части ОГЭ по химии (6.08 MB)
 0
0 63
63 3
3 Нравится
0
Нравится
0


