Новую тему учитель объесняет посредством поэтапного заполнения таблицы. (Приложение 1, слайд 1.)
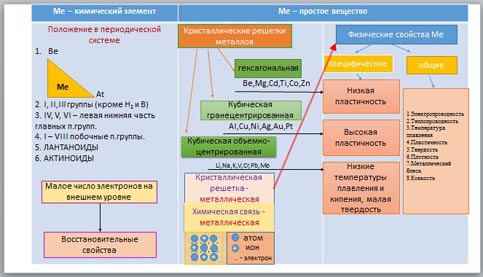
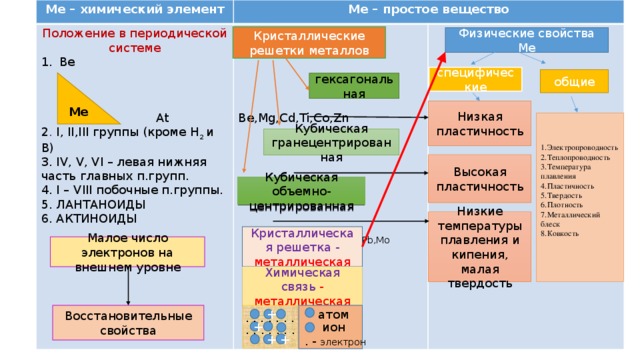
- Записать название таблицы: «Общая характеристика металлов»
- Разбить таблицу на две большие графы: металлы как химические вещества и металлы как простое вещество.
- Рассмотреть положение металлов в периодической системе Д.И.Менделеева и отметить в таблице.
- Восстановительные свойства металлов и строение атома.
- Кристаллические решетки металлов. ( демонстрация моделей кристаллических решеток металлов)
- Химическая связь (металлическая) и её строение. (Демонстрация опыта: изображение металлической связи с помощью двух стеклышек и воды, гле стекла – слой состоящий из атомов и положительно заряженных ионов металла, а вода выполняет роль электронного газа).
- Физические свойства металлов. (зависимость свойст металлов от их химической связи.)
- Общие и спецефические свойства металлов.
- Демонстрация различных образцов металлов.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Свойства металлов (50.39 КB)
Свойства металлов (50.39 КB)
 0
0 268
268 35
35 Нравится
0
Нравится
0


