Министерство образования и молодежной политики Ставропольского края
ГБПОУ «Ставропольский роегиональный многопрофильный колледж»

Рабочая тетрадь
по учебной дисциплине Химия
раздел «Общая и неорганическая химия»
обучающегося_______________
группы_____________________
Ставрополь,2019 г.
Составитель: преподаватель химии Ракчеева Н.А.
Рабочая тетрадь по общей и неорганической химии предназначена для организации самостоятельной работы обучающихся по изучению нового материала и его закреплению. Отдельные занятия выделены на решение расчетных и экспериментальных задач, проведение практических занятий и подготовку к контрольным и самостоятельным работам.
| 1 | Состав, названия основных классов неорганических соединений. | 4 |
| 2 | Основные химические понятия и законы химии. Типы химических реакций | 5 |
| 3 | Характерные свойства основных классов неорганических соединений. | 6 |
| 4 | Расчеты по химическим формулам и уравнениям химических реакций. | 7 |
| 5 | Периодический закон и периодическая система Д.И. Менделеева | 9 |
| 6 | Строение атома. Периодического закона и периодической системы Д.И. Менделеева для развития науки. | 11 |
| 7 | Химическая связь. Строение вещества. | 12 |
| 8 | Закономерности протекания химических реакций. | 13 |
| 9 | Дисперсные системы. | 14 |
| 10 | Теория электролитической диссоциации | 15 |
| 11 | Решение экспериментальных задач по теме «Гидролиз» | 16 |
| 12 | Химические свойства кислот, оснований, солей в свете теории электролитической диссоциации. | 17 |
| 13 | Электролиз. Ряд стандартных потенциалов. | 19 |
| 14 | Окислительно-восстановительные реакции. | 20 |
| 15 | Особенности строения атомов металлов главных подгрупп I- II групп. | 21 |
| 16 | Особенности строения атомов металлов главной подгруппы III группы. | 23 |
| 17 | Свойства металлов побочных подгрупп периодической системы- железа, меди и хрома. | 24 |
| 18 | Состав, свойства, получение и применение металлов и их соединений (оксидов, гидроксидов и др.). | 25 |
| 19 | Химическая и электрохимическая коррозия металлов. Защита металлов от коррозии. | 26 |
| 20 | Химия неметаллических элементов. | 28 |
| 21 | Обобщение знаний по общей и неорганической химии. | 29 |
|
| Литература | 32 |
Задание №1. Заполнить таблицу, распределив вещества по основным классам.
| Основные классы неорганических веществ | ответы |
| 1. Оксиды ЭmOn 2. основания Me(OH)n 3. Кислоты HR 4. Соли MeR |
|
1. Na2O 2. KOH 3.CaCl2 4.LiOH 5.Fe(OH)2 6.AlCl3 7.CaO 8.HCl 9.H2SO4 10. MgSO4.
Задание №2.
Составьте химические формулы возможных оксидов, комбинируя приведенные в таблице части формул слева направо и сверху вниз. Общее число формул равно значению относительной молекулярной массы углерода.
|
|
|
|
| Mg |
|
|
|
|
|
|
|
| Ca | O | S |
|
|
|
|
|
| K2 | O | Zn | O2 | Fe2 |
|
|
|
| P2 | O5 | Cu | O | Al2 | O3 | Li2 |
|
| Na2 | |O | Ba | O | Ag2 | O | C | O | O2 |
________________________________________________________________________________________
________________________________________________________________________________________
Задание №3. Составьте ряд генетически взаимосвязанных веществ:
1.BaSO4, 2.CaO, 3.H2CO3, 4.BaO, 5.Ba, 6.HCl, 7.Na2O 8.Ba(OH)2
________________________________________________________________________________________
_________________________________________________________________________________________
Задание №4. Какое из перечисленных веществ является солью:
а) HNO3 б) KNO3 в) N2O5, г ) H2SO4, Д) H2S Ж) H2SO3
________________________________________________________________________________________
_________________________________________________________________________________________
Задание №1.Привести классификацию химических реакций идущих с изменением состава вещества
________________________________________________________________________________________
________________________________________________________________________________________
________________________________________________________________________________________
________________________________________________________________________________________
(привести пример)
Задание№3. Привести примеры гетерогенных реакций:
________________________________________________________________________________________
________________________________________________________________________________________
Привести примеры гомогенных реакций:
________________________________________________________________________________________
_____________________________________________________________________________________
Задание№4.Дать характеристику реакции синтеза оксида серы (IV) S+O2![]() SO2 по всем возможным признакам классификации химических реакций.
SO2 по всем возможным признакам классификации химических реакций.
________________________________________________________________________________________
_____________________________________________________________________________________
Задание№5. Приведите примеры образования газа, осадка и воды при необратимых реакциях обмена.
________________________________________________________________________________________
_______________________________________________________________________________________
_______________________________________________________________________________________
Задание№6. Написать реакцию бромирования бензола. К какому типу реакций она относится
Задание№7. Написать реакцию разложения оксида ртути (HgO) и нитрата калия (KNO3)
__________________________________________________________________
__________________________________________________________________
Задание№8. Написать реакцию взаимодействия уксусной кислоты с гидроксидом натрия. Определить тип реакции
__________________________________________________________________
Занятие №3. Характерные свойства основных классов неорганических соединений.
Задание №1. Написать уравнения реакций взаимодействия хлора с металлами, которые в данных хлоридах будут проявлять степень окисления +1, +2, +3.
__________________________________________________________________
Задание №2. Решить задачу: Во взаимодействие вступило 20г CaO и 20г CO2. Какова масса и состав образовавшейся соли?
Дано: Решение:
Найти:
Ответ:____________
Задание №3.Составить молекулярные и ионные уравнения реакций между веществами:
а) HCOOH и Ca (OH)2
б) Fe (OH)3 и HCl
в) Pb (OH)2 и HCl
г) K2CO3 + HCI
__________________________________________________________________
Задание №4. Определить возможность протекания реакций обмена между водными растворами веществ:
а) сульфатом калия и гидроксидом бария;
б) карбонатом натрия и хлоридом кальция;
в) нитратом меди(II) и сульфатом железа (II)
г) гидроксидом натрия и серной кислотой;
д) сульфатом калия и азотной кислотой
Составить уравнения возможных реакций в молекулярной, ионной и сокращённой ионных формах.
Занятие №4. Расчеты по химическим формулам и уравнениям химических реакций.
Задание №2. Решить задачу: К 150г раствора с массой долей K2SO4 10% добавили 100г воды. Вычислить массовую долю сульфата калия в полученном растворе.
Дано: Решение:
Найти:
Ответ:____________
Задание №3. Решить задачу: Смешали хлороводород массой m = 7,3г и аммиак m = 4 г. Вычислить массу образовавшегося хлорида аммония:
Дано: Решение:
Найти:
Ответ:____________
NO
HNO3NaNO3NaNО2HNO2
HNO3
|
| Ba(NO3)2 | AgNO3 | H3PO4 | H2SO4 |
| Ba(NO3)2 |
|
|
|
|
| AgNO3 |
|
|
|
|
| Н3PO4 |
|
|
|
|
| H2SO4 |
|
|
|
|
Дано: Решение:
Найти:
Ответ:____________
Занятие 5. Периодический закон и периодическая система Д.И. Менделеева
Задание №1.Дать формулировку периодического закона
Задание №2. Как, исходя из строения атома, объяснить, что при переходе от углерода к свинцу неметаллические свойства ослабевают и возрастают металлические
Задание №3. Как изменяются:
а) радиус атома у галогенов в группе сверху вниз
б) электроотрицательность?
Задание№4. Металлические свойства элементов 3-го периода от Na к Cl
а)усиливаются в)не изменяются б)ослабевают
Ответ поясните.
Задание №5. В состав оксидов ЭO2 могут входить атомы элементов
а )азот б)углерод в)магний г)сера
Задание 6. Решить кроссворд.
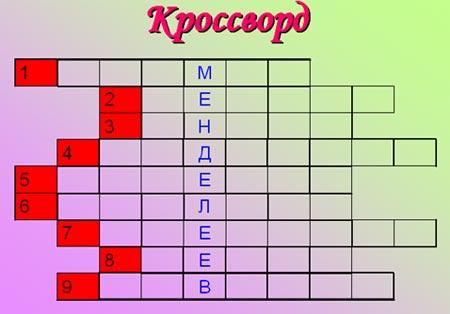
Индикатор.
Растворимое в воде основание.
Элемент III группы, 5 периода.
Основная отрасль использования кислорода.
Драгоценный металл.
Гидроксид, соответствующий оксидам неметаллов.
Отрицательно заряженная частица, входящая в состав атома.
Элемент VI группы, 4 периода.
Месяц, в котором был открыт периодический закон.
Занятие 6. Строение атома. Распределение электронов по энергетическим уровням. Значение Периодического закона и периодической системы Д.И. Менделеева для развития науки.
Задание №1. Продолжить определение: Атом –
Задание №2. Определить число протонов и нейтронов в ядрах атомов железа, кальция, кислорода, серы
_____________________________________________________________________________
Задание №3. Дать понятие изотопов. Привести примеры.
Задание №4. Дать общую характеристику элемента с порядковым номером 33. Указать его основные химические свойства.
_____________________________________________________________________________
Задание №5.Определить валентность и степень окисления атомов углерода в веществах с формулами : C2H6 ; C2H4; C2H2
Задание №6. В чём значение Периодического закона и Периодической системы химических элементов Д.И. Менделеева?
Задание №1. Продолжить определение: Электроотрицательность элементов- это________________________________________________________________
Задание №2. Какой тип связи в молекуле PF3 (выбрать правильный ответ):
а)полярная ковалентная
б)неполярная ковалентная
в)ионная
Задание №3. Дать определение ковалентной связи? Между атомами каких элементов возникает ковалентная связь
Задание №4. Дать определение ионной связи.
Задание №5. Соединение, в котором имеются только ионные связи, - это
а) H2SO4 б)Na2S в)Na2O2 г)NH4Cl
Задание №6. Определить степень окисления атомов в соединениях: HNO3, KClO3, K3PO4, K2SO3, KAl(SO4)2
Задание№7.Атом водорода образует водородную связь лишь с атомами определённых элементов, к которым относятся атомы-
____________________________________________________________________________
Задание№8. Определить тип связи в молекулах: KCI, Cl2, HCl, AgCl, Cu, Na2O2, Fe, H2O
____________________________________________________________________________
____________________________________________________________________________
Занятие 8. Закономерности протекания химических реакций
Задание№1. Дать понятие следующим определениям: скорость химической реакции, скорость гетерогенной реакции, скорость гомогенной реакции, факторы скорости химической реакции, катализатор, ингибитор, катализ, каталитические химические реакции, гомогенный катализ, гетерогенный катализ, адсорбция, адсорбенты.
Задание№2. Написать уравнение реакций взаимодействия соляной кислоты с магнием и цинком. Указать в каком случае реакция протекает с большей скоростью. Почему?
Какой из факторов оказал влияние на скорость химической реакции?
_________________________________________________________________________
Задание№3.Определить скорость химической реакции А+B=AB, если начальная концентрация вещества А была равна 1 моль/л, а через 4 сек. концентрация этого вещества стала 0,6моль/л.
Д ано: Решение:
ано: Решение:
Найти:
Ответ:_________________
Занятие 9. Дисперсные системы.
Задание№1. Продолжить определение: дисперсными называют ________________системы, в которых_______________________________
_____________________________________________________________________________
_____________________________________________________________________________
Задание №2 Вещество, которое присутствует в ______________ количестве и распределено в объёме другого, называют________________________________ .
Вещество присутствующие в количестве, в объёме которого распределена____________________ называют ______________________ .
Задание№3. Какой раствор называют истинным? Привести примеры.
_____________________________________________________________________________
Задание№4. Привести примеры взвесей ____________________________________
Задания№5. Привести примеры коллоидных растворов __________________
Задание№6. Явление слипания коллоидных частей называют______________
__________________________________________________________________
Задание№7. Значение различных дисперсных систем быту:
_____________________________________________________________________________
Занятие №10.Теория электролитической диссоциации Аррениуса. Реакции ионного обмена.
Задание №1. Дать понятие электролитов и неэлектролитов (привести примеры)
Электролиты- это
Неэлектролиты- это
Задание №2.Какие из следующих жидкостей проводят электрический ток: этиловый спирт, водный раствор глюкозы, водный раствор гидроксида натрия, раствор кислорода в воде, водный раствор карбоната натрия, расплав гидроксида калия? Ответ объясните.
_____________________________________________________________________________
___________________________________________________________________
Задание №3.Составьте уравнения диссоциации следующих электролитов: KOH, Al(NO3)2, K3PO4, NiSO4, HNO3, Ca(OH)2, FeCl3, Na2HPO4, HCOONa.
_____________________________________________________________________________
____________________________________________________________________________
__________________________________________________________________________
___________________________________________________________________________
Задание №4.Составьте молекулярные и ионные уравнения реакций между веществами:
а) KOH и MgCl2__________________________________________________
б) NaOH и H2SO3__________________________________________________
в) CH3COONa и H2SO4_____________________________________________________
г)Na2S и HCl_______________________________________________________
д)Na2SO4 Ва(NO3)2_________________________________________________
Задание №5.
Напишите полные и сокращённые ионные уравнения возможных реакций между попарно сливаемыми растворами солей: AgNO3, Na2CO3, CaCl2
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
Занятие №11 Гидролиз солей.
Задание №1. Дать определение гидролиза солей
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
_________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
____________________________________________________________________________
_____________________________________________________________________________
Задание №4. Перечислить факторы, влияющие на степень гидролиза
____________________________________________________________________________
____________________________________________________________________________
_____________________________________________________________________________
Занятие №12.Химические свойства кислот, оснований, солей в свете теории электролитической диссоциации.
Задание №1. В молекулярном уравнении реакции
Cr2O3 + О2 + К2СО3 - К2СгО4 + СО2
сумма коэффициентов равна 1)5 2)17 3)23 4)34
_____________________________________________________________________________
Задание №2. Решить задачу. При рентгеноскопическом исследовании организма человека применяют так называемые рентгеноконтрастные вещества. Так, перед просвечиванием желудка пациенту дают выпить суспензию труднорастворимого сульфата бария, не пропускающего рентгеновское излучение. Какие количества оксида бария и серной кислоты потребуются для получения 100 сульфата бария?
Д ано: Решение:
ано: Решение:
Найти:
Ответ:_________________
Задание №3. Из раствора сульфата цинка(II) выпадает осадок при добавлении каждого из веществ набора (написать уравнения реакций)
1) НС1, LiOH 2) Ва (ОН)2, ВаС12
3) Са (ОН)2, HNO3 4) Ва (ОН)2, А1(ОН)3
____________________________________________________________________________
____________________________________________________________________________
_____________________________________________________________________________
Задание №4. В схеме превращений CaCO3 X CaCl2 веществом «Х» является А) CaO Б) Ca(OH)2 В) CaH2
____________________________________________________________________________
_____________________________________________________________________________
Задание №5. Решить задачу. Найти массовую долю глюкозы в растворе, содержащем 280г воды и 40г глюкозы.Д ано: Решение:
ано: Решение:
Найти:
Ответ:_________________
Задание №6. Привести примеры образования газа, осадка и воды при необратимых реакциях обмена.____________________________________________________________________________
____________________________________________________________________________
_____________________________________________________________________________
Занятие №13.Электролиз. Ряд стандартных потенциалов.
Задание №1. При электролизе водного раствора сульфата меди (II) на катоде выделяется: а) медь, б) вородов, в) кислород, г) оксид серы (IV)
____________________________________________________________________________
_____________________________________________________________________________
Задание №2..Установите соответствие между формулой соли и продуктом, который образуется на аноде в результате электролиза её водного раствора:
| Формула соли | Продукт на аноде | ||
| А) | K3PO4 | 1) | кислород |
| Б) | FeCl3 | 2) | оксид фосфора (V) |
| В) | NiSO4 | 3) | оксид серы (IV) |
| Г) | CrBr2 | 4) | водород |
|
|
| 5) | галоген |
____________________________________________________________________________
_____________________________________________________________________________
Задание №3.. При электролизе водного раствора хлорида меди (II) на катоде выделилось 12,8 г металла. Объем газа, выделившегося на аноде, равен при нормальных условиях _____л. (Запишите число с точностью до сотых).
Задание №4.. Составьте уравнение реакций, протекающих на катоде и аноде, и суммарное уравнение электролиза водного раствора сульфата калия.
____________________________________________________________________________
____________________________________________________________________________
_____________________________________________________________________________
Задание №5.. Составьте уравнение реакций, протекающих на катоде и аноде, и суммарное уравнение электролиза водного раствора хлорида лития.
____________________________________________________________________________
_____________________________________________________________________________
Задание №6..Установите соответствие между формулой соли и уравнением процесса, протекающего на катоде в результате электролиза её водного раствора:
| Формула соли | Процесс, протекающий на катоде | ||
| А) | HNO3 | 1) | 2H2 + 2e → H2 |
| Б) | KOH | 2) | 2H2O + 2e → H2 + 2OH- |
| В) | BaCl2 | 3) | K+ + 1e → K0 |
| Г) | AgNO3 | 4) | Ba2+ + 2e → Ba0 |
|
|
| 5) | Ag+ + 1e → Ag0 |
|
|
| 6) | 4OH- - 4e → O2+ 2H2O |
____________________________________________________________________________
_____________________________________________________________________________
Занятие №14. Окислительно-восстановительные реакции.
Задание №1.. Продолжить определение: окислительно – восстановительные реакции – это
__________________________________________________________
__________________________________________________________
(привести пример)
Задание №2..По изменению степени окисления определить в схемах, какие процессы произошли (окисление или восстановление), записать это под стрелкой, а над стрелкой указать число потерянных (с минусом) или число приобретённых (с плюсом) электронов.
Например: Clo ![]() Cl-
Cl-
Восстановление
А )Cl+5 ![]() Cl- _____________________________________________________________
Cl- _____________________________________________________________
б) F2o ![]() F- _____________________________________________________________
F- _____________________________________________________________
в) J- ![]() J2o __________________________________________________________________
J2o __________________________________________________________________
г )Cl2o ![]() Cl-
Cl-
Задание №3. Определить степень окисления хлора в следующих соединениях: а)NaCl, б)KClO, в)CI2, г)BaCl2, д)KСlO3, е)Ca(ClO4)2
Задание №4.Определить, какие реакции являются окислительно – восстановительными:
а) CaO + H2O = Ca (OH)2
б )Ca + H2O = Ca (OH)2 + H2
в) H2 + J2 = 2HJ
г) HJ + KOH = KJ + H2O
д) 2KJ + Cl2 = 2KCl + J2
Задание №5. Составьте уравнения окислительно – восстановительных реакций с участием галогенов.
а) … + Br2![]() AlBr3
AlBr3
б) Al + J2 ![]() …
…
в) H2 + Br2 ![]() …
…
г) NaJ + Br2 ![]() …
…
д) MgBr2 + Cl2 ![]() …
…
Укажите окислитель и восстановитель.
_____________________________________________________________________________
Занятие №15. Особенности строения атомов металлов. Получение, химические свойства, применение металлов главных подгрупп I- II групп.
Задание №1.Закончить реакцию взаимодействия металлов с простыми веществами
а) Na+Cl_________________________________________
б) Na+О2________________________________________
в) Na+H2________________________________________
а) NaO2NaClNaOH
NaOHNa2SO4NaNO3
Д ано: Решение
ано: Решение
Ответ:________
Задание№4. Продолжить уравнения реакций, указать тип каждой:
Nа+Н3PO4![]()
Mg+НBr![]()
K2O+НNO3![]()
Na2O + HCl →
NaOH + HCl →
Задание№5. Какое из перечисленных утверждений не характеризует щелочи:
а) это основания, растворимые в воде
б) в растворе они изменяют окраску индикатора – фенолфталеина
в) они взаимодействуют с кислотами с образованием солей и воды
г) они взаимодействуют с оксидами неметаллов
д) они взаимодействуют с оксидами металлов
Задание№6. Количество гидроксида калия, способного вступить в реакцию с 4 моль серной кислоты, равно …1) 0,8 моль; 2) 8 моль; 3) 80 моль; 4) 4 моль
Задание№7. Напишите уравнения реакций, позволяющих осуществить следующие превращения: NаСl → Nа → NаН → NаОН → NаНSО3.
Занятие №16. Особенности строения атомов металлов. Получение, химические свойства, применение металлов главной подгруппы III группы.
Задание№1. Ответить на вопрос: почему алюминий называют металлом будущего?
Задание№2. Составить сообщение на тему: «Получение Al в промышленности»
Задание№3. Ответить на вопросы:
1. Каков порядковый номер алюминия?___________________________
2. Алюминий элемент III группы, какой подгруппы?____________________
3. Какому элементу соответствует строение электронной оболочки
2е 8е 3е?_________
4. Чему равна валентность алюминия?__________
5. Чему равно число электронов в атоме алюминия?__________
6. Чему равно число протонов в ядре атома алюминия?________
7. Какой характер имеют оксид и гидроксид алюминия?_______
8. Чему равно число нейтронов в ядре атома алюминия?________
9. Каков характер простого вещества алюминия? (… металл)_____
10. Как называется сплав на основе алюминия?______________
11. Как называется соль алюминиевой кислоты?_____________
12. Каково число электронов на внешнем уровне в атоме алюминия?_______
Задание№4. Написать уравнения реакции, с помощью которых в промышленности получают алюминий:
__________________________________________________________________________________________________________________________________________________________
Задание № 5. Решить задачу: Смесь алюминия и меди массой 5г обработали водным раствором щелочи. При этом образовался газ объемом 2.241 (н.д.) Вычислить массовую долю алюминия в смеси.
Д ано: Решение:
ано: Решение:
Ответ: ______________
Задание № 6. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения; Al →Al2(SO4)3 → Al(OH)3 → Al(NO3)3.
Занятие №17. Свойства металлов побочных подгрупп периодической системы- железа, меди и хрома.
Задание № 1. Написать уравнение реакций следующих превращений:
СuCu(No3)2Cu(OH)2CuOCuCuCl2
CuSO4
Задание № 2. Решить задачу: Технический цинк массой 0,33г обработали разбавленным раствором серной кислоты. Выделившийся водород занимают при н.у. 112мл. Рассчитать массовую долю цинка в техническом металле:
Д ано: Решение:
ано: Решение:
Ответ: _______________
Задание № 3. Какой металл в следующем ряду является наиболее активным : Fe, Zn, Mn, K, Au. Ответ поясните.
__________________________________________________________________
__________________________________________________________________
Задание № 4. Химические свойства хрома:
Задание № 5.Какой из металлов побочных подгрупп имеет наибольшие практическое значение:
а) Cu, Zn, Ti, Cr, Fe
б) Ag, Au, Sn, Zn, Na
в) Na, Sn, Pb, K, Te.
Занятие №18. Состав, свойства, получение и применение металлов и их соединений (оксидов, гидроксидов и др.).
Задание № 1. Выписать отдельно оксиды металлов и оксиды неметаллов и дайте им названия:
Na2O, H2O, CaCl2, NO, BaO, NaOH, SO3, LiOH, HCl, SO2, FeO, HNO3, CO2, CaS, CuO, P2O5.
Задание № 2. Составьте основания из оксидов: ZnO, Li2O, MgO.
Задание № 3. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: Cu → CuCl2 → Cu(NO3)2 → Cu(OH)2→ CuO → Cu
Задание № 4. Дайте характеристику реакции синтеза оксида серы (VI) по всем возможным признакам.
Задание № 5. Рассчитайте массу нитрата меди, которая может быть получена из 38,4 г меди.
Д ано: Решение:
ано: Решение:
Ответ: _______________
Занятие №19. Химическая и электрохимическая коррозия металлов. Защита металлов от коррозии.
Задание № 1. Продолжить определение: коррозия-это
Задание № 2. Виды коррозии-
Задание № 3. Способы защиты от коррозии-
Задание № 4. Рассмотрите коррозию железа в водопроводной и «морской» воде. Где процесс протекает быстрее и чем вы это объясните?
Задание № 5. Рассмотрите процесс коррозии при соединении медной трубы с гальванизированной (оцинкованной) стальной трубой, если обе трубы находятся в земле.
Задание № 6. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?
Занятие № 20. Химия неметаллических элементов.
Задание№1. Древесный уголь применяется в противогазах ив процессе очистки сахара благодаря свойству:
а) черный цвет; в) растворимость;
б) способность адсорбировать; г) все перечисленные.
Задание№2. Растворимым стеклом называют:
а) водный раствор силикатов натрия и калия;
б) кремниевую кислоту;
в) кремний(IV) оксид;
г) водный раствор натрий карбоната.
_________________________________________________
Задание№3.Минимальная отрицательная степень окисления атома неметалла равна:
а) номеру группы;
б) номеру периода;
в) порядковому номеру;
г) разности номера группы и числа 8.
____________________________________________________
Задание№4. Кремний (IV) оксид не реагирует с:
а) натрий гидроксидом;
б) калий карбонатом;
в) кальций оксидом;
г) водой.
____________________________________________________
Задание№5. Углерод(II) оксид и углерод (IV) оксид отличаются между собой:
а) цветом;
б) запахом;
в) качественным составом;
г) способностью восстанавливать металлы из их оксидов.
_____________________________________________________
Задание№6.В схеме превращений Na![]() SiO
SiO![]() → A → Б→ Na
→ A → Б→ Na![]() SiO
SiO![]() буквой «А» и «Б» зашифрованы вещества, формулы которых:
буквой «А» и «Б» зашифрованы вещества, формулы которых:
а) А - SiO![]() , Б - H₂SiO
, Б - H₂SiO![]() ;
;
б) А - K![]() SiO
SiO![]() , Б - K
, Б - K![]() SiO
SiO![]() ;
;
в) А - H₂SiO![]() , Б - SiO
, Б - SiO![]() .
.
Занятие №21. Обобщение знаний по общей и неорганической химии.
Задание №1. Определить валентность и степень окисления атомов в веществах с формулами:N2; NF3; NH3; H2O, OF2
_____________________________________________________________________________
Задание №2. Написать электронную формулу хлора___________________
Задание №3. Как, исходя из строения атома, объяснить, что при переходе от углерода к свинцу неметаллические свойства ослабевают и возрастают металлические
Задание №4. В чём причина многообразия органических веществ.
Задания№5.Написать структурные формулы этана, этена, этина
Задания№6. Чем объяснить, что при обычных условиях этилен – газ, а полиэтилен – твёрдое, нелетучее вещество.
Задания№7. Как изменяется активность элементов в ряду F-Cl-Br-J?
Задание№8. Решить задачу. Найти массу серной кислоты, необходимую для полной нейтрализации 100г гидроксида калия .
Дано: Решение:
Ответ: ___________
Задание№9. Написать реакцию разложения оксида ртути(HgO) и нитрата калия (KNO3)
_________________________________________________________________________
Задание№10. Написать реакцию взаимодействия уксусной кислоты с гидроксидом натрия. Определить тип реакции.
Задание№11. Написать уравнения реакций взаимодействия хлора с металлами, которые в данных хлоридах будут проявлять степень окисления +1, +2, +3. Какой вид химической связи у полученных соединений?
Задание№12. Решить задачу:Во взаимодействие вступило 20г CaO и 20г CO2. Какова масса и состав образовавшейся соли?
Дано: Решение:
Найти:
Ответ:__________
Задание №13.Составить молекулярные и ионные уравнения реакций между веществами:
а) HCOOH и Ca (OH)2
б) Fe (OH)3 и HCl
в) Pb (OH)2 и HCl
г) K2CO3 + HCI
__________________________________________________________________
Задание №14. Определить возможность протекания реакций обмена между водными растворами веществ:
а) сульфатом калия и гидроксидом бария;
б) карбонатом натрия и хлоридом кальция;
в) нитратом меди(II) и сульфатом железа (II)
г) гидроксидом натрия и серной кислотой;
д) сульфатом калия и азотной кислотой
Составить уравнения возможных реакций в молекулярной, ионной и сокращённой ионных формах.
Задание №15. Какие из веществ взятых попарно, можно использовать для получения хлороводорода? Составить уравнения возможных реакций
а) KCl, б) CaCl2, в) K2SO4, г) KOH, д) H2SO4.
Задание №16. Какие оксиды получаются при разложении гидроксидов: Cu(OH)2,Fe(OH)3, H2SiO3, Al(OH)3, H2SO4.
Написать уравнения реакций: ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание №17. Осуществить превращения: Fe → FeCl2 → FeSO4 → Fe2(SO4)3 → Fe(OH)3 → Fe2O3
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
1.Габриелян, О.С. Остроумов, И.Г. Химия для профессий и специальностей технического профиля, учебник для студ. учреждений сред. проф. образования. — М., 2018.
2.Габриелян, О.С. Остроумов. И.Г. Сладков, С.А. Дорофеева, Н.М. Практикум учеб. пособие для студ. учреждений сред. проф. образования. — М., 2018.
3.Габриелян, О.С. Лысова, Г.Г. Химия. Тесты, задачи и упражнения, учеб. пособие для студ. учреждений сред. проф. образования. — М., 2018.
4.Ерохин, Ю.М. Химия: Задачи и упражнения учеб. пособие для студ. учреждений сред. проф. образования. — М., 2018.
32
 Получите свидетельство
Получите свидетельство Вход
Вход












 Рабочая тетрадь по учебной дисциплине Химия раздел «Общая и неорганическая химия» (268.5 KB)
Рабочая тетрадь по учебной дисциплине Химия раздел «Общая и неорганическая химия» (268.5 KB)
 0
0 384
384 25
25 Нравится
0
Нравится
0


