
( 8 класс)

Ребята, у нас с вами сегодня не просто урок, а научно-исследовательская лаборатория, а вы не ученики, а лаборанты-исследователи, которые должны самостоятельно с помощью эксперимента дать ответ на один единственный вопрос: «Что такое оксиды и каковы их свойства»

- 1. Сформировать представления об оксидах, их составе и классификации.
- 2. Выяснить различия и сходства между кислотными и основными оксидами.
- 3. Выяснить основные свойства оксидов.
- 4. Закрепить умения определять валентность элементов в соединении, составлять формулы бинарных соединений, давать названия веществам.
- 5. Приобрести и закрепить новые умения по изучению веществ, составлению уравнений химических реакций.

Прежде чем приступить к исследовательской работе, вы должны пройти небольшой тест:
- Сколько химических элементов известно
в настоящее время:
а) 101; б) 104; в) 114; г) 63?
2. Каково из элементов по массе больше
всего на Земле?
а)водорода; б) кислорода; в) углерода?
3. Как вы думаете, какого кислорода больше:
а) свободного (в виде простого вещества);
б) связанного?
4. В состав каких веществ входит кислород:
а)вода; б)соль; в)углекислый газ; г)сахар;
д)мел; е)соляная кислота; ж)сода; з) жир.

В нашу лабораторию пришел заказ: «Изучить и дать конкретные выводы о веществах, которые называются «оксиды»
По накладной мы получили восемь склянок и этикетки с названиями, вложенные в эти пробирки. Выньте таблички, прочитайте название, перепишите формулы в тетрадь.
Н 2 О
AL 2 O 3
СаО
SiO 2
CO 2
P 2 O 5
Fe 2 O 3
CuO
Щелкнуть по пробиркам.
Сравните, что общего и чем отличаются формулы этих
веществ друг от друга. Попробуйте распределить их на две
группы. Какой признак вы взяли за основной?
Опишите агрегатное состояние при обычных условиях каждого оксида.

Сделайте выводы :
- 1 . Оксиды- это простые или сложные вещества?
- 2. Сколько элементов входит в состав оксидов?
- 3. На какие две основные группы можно раз-
делить оксиды?
- 4. Какова валентность кислорода в соединении?
Как вы думаете, почему оксиды неметаллов называются кислотными, а оксиды металлов – основными?
Щелкнуть по подчеркнутому слову и рукописи.
Если вам, друзья-лаборанты, трудно ответить на этот вопрос, вам поможет разобраться в этом найденное письмо.

Один невнимательный лаборант составлял перечень оксидов, имеющихся в лаборатории и пропустил некоторые графы в табеле. Заполните их:
Название оксида
Молекулярная формула
Оксид серы( VI)
N 2 O 5
Оксид углерода( IV )
AL 2 O 3
Оксид натрия
Mn 2 O 7

Для изучения свойств оксидов нам необходимо уметь четко отличать их друг от друга и правильно давать названия. Поэтому сыграем с вами в игру «третий лишний»:
В какой из строк перечислены только:
- основные оксиды?
- кислотные оксиды?
а) CaO, BaO, N 2 O 5 ; в ) P 2 O 5 , С O 2 , SiO 2 ;
б ) Na 2 O, MgO, FeO; г ) SO 3 , CO 2 , Li 2 O.
Составьте формулы оксидов по их названиям:
Оксид серы ( IV )
Оксид алюминия
Оксид цинка
Оксид фосфора ( V )
Оксид натрия
Оксид серы (VI )
Оксид кремния
Оксид углерода (II )
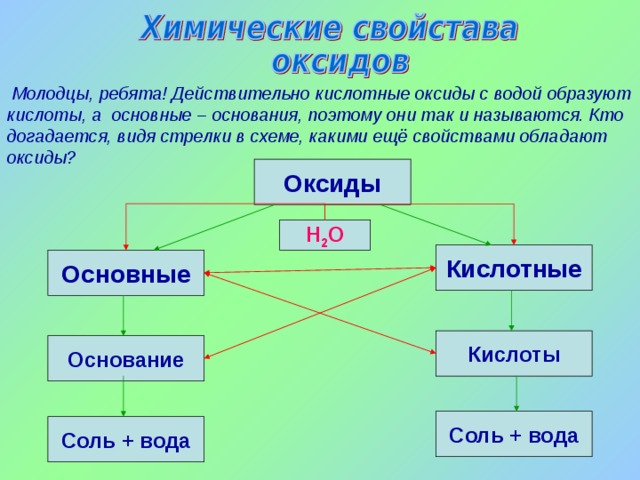
Молодцы, ребята! Действительно кислотные оксиды с водой образуют кислоты, а основные – основания, поэтому они так и называются. Кто догадается, видя стрелки в схеме, какими ещё свойствами обладают оксиды?
Оксиды
Н 2 О
Кислотные
Основные
Кислоты
Основание
Соль + вода
Соль + вода

К нам в лабораторию пришло видеописьмо, в котором говорится о химических свойствах оксидов. Перед вами поставлены задачи:
- Дополнить и дать полный комментарий к тому, что вы увидите
и услышите.
2. Написать уравнения продемонстрированных химических превращений .
I .Свойства основных оксидов.
1. Взаимодействие с водой.
CaO + H 2 O = Ca(OH) 2
2 . Взаимодействие с кислотами.
С uO + H 2 SO 4 = CuSO 4 + H 2 O
II . Свойства кислотных оксидов.
1. Взаимодействие с водой.
Щелкнуть по видеоленте.
P 2 O 5 + 3H 2 O = 2H 3 PO 4
2 . Взаимодействие с основанием.
СО 2 + Са(ОН) 2 = СаСО 3 + Н 2 О
III . Взаимодействие оксидов друг с другом.
Na 2 O + SO 3 = Na 2 SO 4
9

Внимание, внимание! Пришло задание! Друзья - научные сотрудники, опытным путем докажите ,что оксид магния– основной оксид, а оксид фосфора( V )–кислотный.
Не забудьте соблюдать правила техники безопасности!
Ход работы:
- Возьмите две пробирки. В одну из них насыпьте немного оксида магния, а в другую – оксида фосфора.
2. В пробирку с оксидом магния осторожно налейте раствор серной кислоты ( около 1 мл). Для ускорения взаимодействия осторожно нагрейте содержимое пробирки. Что наблюдаете?
При нагревании держите пробиркодержатель так, чтобы отверстие проборки было направлено в сторону от вас и соседа!
3. В пробирку с оксидом фосфора осторожно налейте раствор гидроксида натрия ( около 1 мл). Что наблюдаете?
4. После окончания реакций поставьте пробирки в штатив и с помощью стеклянной палочки перенесите каплю полученного раствора (из каждой пробирки) на стеклянную пластинку. Выпарите их. Что осталось на пластинке?
Щелкнуть по знаку.
9

Наша лаборатория получила заказ на получение оксидов из следующих веществ:
а) серы; б) фосфора; в)магния; г) железа.
Запишите уравнения реакций получения этих оксидов. Дайте названия полученным веществам.
в) 2Mg+O 2 = 2MgO
а) S+O 2 = SO 2
б ) 4P+5O 2 = 2P 2 O 5
г) 3Fe+2O 2 = Fe 3 O 4
Щелкнуть по подчеркнутым словам.
Как называется тип протекающих химических реакций?
Дайте определение реакции горения .
9

Был найден листок, но записи на нем
частично исчезли, необходимо восстановить их.
- C + ? = CO Na + ? =Na 2 O
- ? + O 2 =BaO SO 2 + ? = SO 3
- Al + O 2 = ? ? + O 2 = CaO
Дайте названия полученным веществам.

В нашу лабораторию пришло ещё одно письмо:
Здравствуйте, здравствуйте!
Не могли бы вы мне ответить на такой вопрос: почему алюминиевая посуда служит долго и не ржавеет? Правда ли, что при соприкосновении с кислородом воздуха на её поверхности образуется оксидная плёнка, которая защищает металл от дальнейшего разрушения? Сам я плохо знаю химию и не могу написать уравнение реакции. Помогите разобраться!
С уважением Иванов.
4AI + 3O 2 = 2AI 2 O 3( оксид алюминия)

Молодцы, ребята! Вы сегодня хорошо поработали! И на последок, для закрепления материала давайте отгадаем загадки, которые мы нашли случайно в нашей лаборатории:
Узнай меня! Я газ. Я прост.
Я рыжий, словно лисий хвост.
***
Два элемента в них всего-
Кислород важней всего!
***
Мы - весёленький народ
Элемент и кислород,
В формулах оксидов
Главные два вида.
***
Чтоб появиться я сумел,
Прокаливают белый мел,
Меня дает огонь в печи
И пламя маленькой свечи
И стоит только сделать вдох,
Чтоб я на свет явиться смог.
Единственное вещество в природе, которое в земных условиях существует во всех трех агрегатных состояниях: жидком, твердом и газообразном.
***

- 1.Выучить схему « Химические свойства оксидов».
- 2. Составить уравнения реакций химических свойств следующих оксидов: CO 2 и Na 2 O .

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация по теме "Оксиды". 8 класс (1.45 MB)
Презентация по теме "Оксиды". 8 класс (1.45 MB)
 0
0 1542
1542 432
432 Нравится
0
Нравится
0


