
NH 3

Я скажу себе, друзья,
Не боюсь я никогда
Ни диктанта,
Ни контрольной,
Ни стихов и ни задач,
Ни проблем, ни неудач.
Я спокоен, терпелив,
Сдержан я
И не хмурлив.

Содержание презентации
NH 3
1. История получения аммиака.
- Строение атома азота.
3. Образование молекулы.
4. Строение молекулы аммиака.
5. Физические свойства.
6. Способы получения аммиака.
7. Химические свойства.
8. Образование иона аммония.
9. Токсичность аммиака.
- Применение аммиака.
- Готовимся к экзамену.

Происхождение названия
NH 3
- Аммиак также может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей.
- В очень жарком климате мочевина (NH 2 ) 2 CO, разлагается особенно быстро.
Одним из основных продуктов разложения и является аммиак.
Оазис «Аммон»
в Северной Африке

Происхождение названия
NH 3
- По некоторым другим сведениям, аммиак мог получить современное название от древнеегипетского слова «амониан».
Так называли всех
верующих людей, поклоняющихся богу Амону.
- Люди во время своих ритуальных обрядов нюхали NH 4 Cl, который при нагревании издаёт запах аммиака.
Бог Амон в образе барана
VIII в. до н.э. (Музей г. Мероэ, Судан)

Происхождение названия
NH 3
- Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый-химик, академик Яков Дмитриевич Захаров, который впервые разработал также и систему русской химической номенклатуры.
1781-1852 г.

История открытия аммиака
NH 3
Аммиак был получен в чистом виде
в 1774 г. английским химиком
Джозефом Луи Пристли.
Он нагревал аммониак (хлорид аммония)
с гашеной известью (гидроксид кальция).
Пристли назвал газ «щелочным воздухом
или летучей щелочью»,
поскольку водный раствор
аммиака имел все признаки щелочи.
17 1 1-1 794 г.

История открытия аммиака
NH 3
В 1784 французский химик Бертолле
разложением аммиака доказал
его элементный состав,
который в 1787 получил официальное
название «нашатырь» – от
латинского названия
нашатырной щелочи – sal ammoniac.
Это название сохраняется и до сих пор
в большинстве
западноевропейских языков
(нем. Ammonium chloride,
англ. Ammonia, фр. ammoniaque).
17 23 -1 802 г.

Строение атома азота
NH 3
+7 N ) )
2 5
N
7
N
2p
Азот
2 s
14,0067
2
5
2 s 2 2p 3
Электронная формула имеет вид:
1 S 2 2 S 2 2 P 3
Таким образом, атом азота имеет на последней
(2 р) орбитали 3 неспаренных электрона.
:
:
:
:
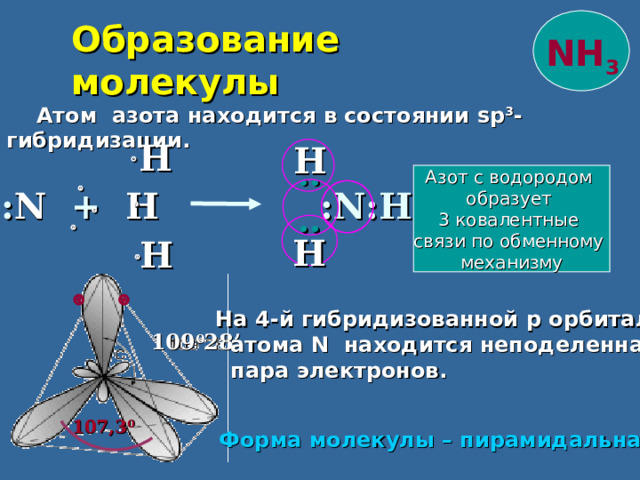
Образование молекулы
NH 3
Атом азота находится в состоянии sp 3 - гибридизации.
Н
Н
Н
Азот с водородом
образует
3 ковалентные
связи по обменному
механизму
: N + H : N :Н
Н
Н
Н
На 4-й гибридизованной p орбитали
атома N находится неподеленная
пара электронов.
109 0 28 ’
107,3 0
Форма молекулы – пирамидальная.
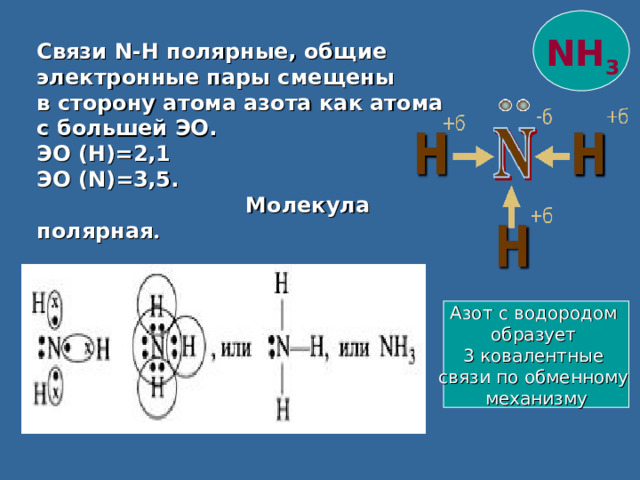
NH 3
Связи N-H полярные, общие электронные пары смещены
в сторону атома азота как атома
с большей ЭО.
ЭО (Н)=2,1
ЭО ( N) =3,5.
Молекула полярная .
Азот с водородом
образует
3 ковалентные
связи по обменному
механизму
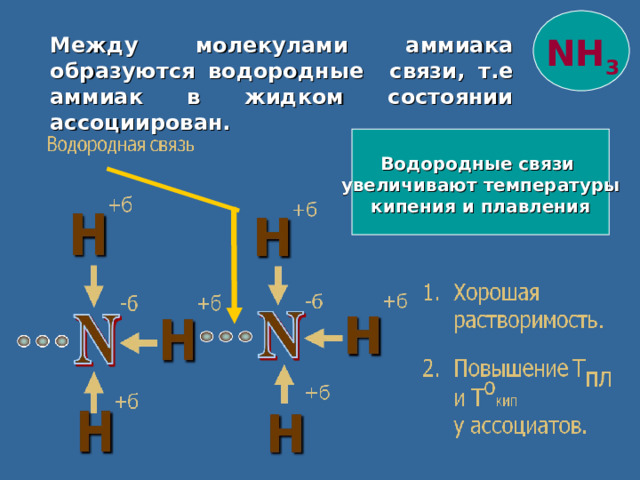
NH 3
Между молекулами аммиака образуются водородные связи, т.е аммиак в жидком состоянии ассоциирован.
Водородные связи
увеличивают температуры
кипения и плавления
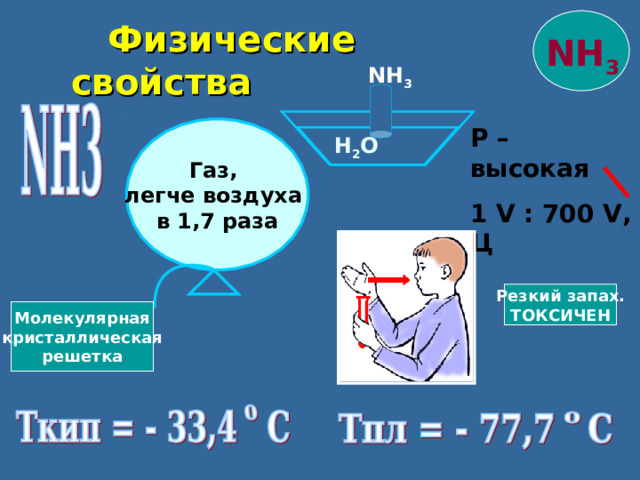
Физические свойства
NH 3
NH 3
Р – высокая
1 V : 700 V , Ц
Газ,
легче воздуха
в 1,7 раза
H 2 O
Резкий запах.
ТОКСИЧЕН
Молекулярная
кристаллическая
решетка
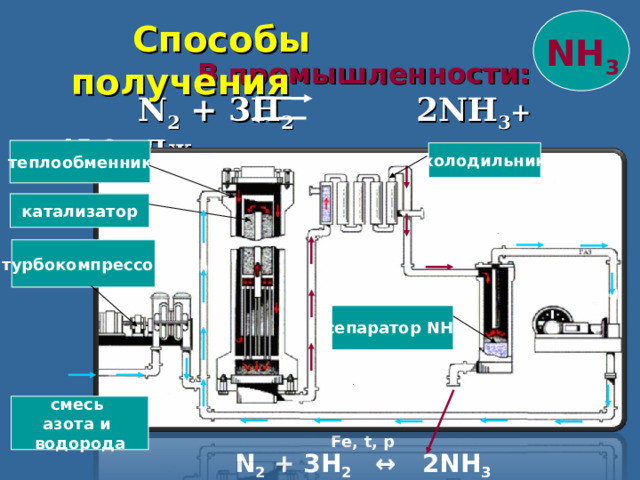
Способы получения
NH 3
В промышленности:
N 2 + 3H 2 2NH 3 + 45,9 кДж
теплообменник
холодильник
катализатор
турбокомпрессор
сепаратор NH 3
смесь
азота и
водорода
Fe, t, p
N 2 + 3H 2 ↔ 2NH 3

NH 3
В лаборатории:
1. Действием щелочей на
соли аммония:
2. Гидролиз нитридов:
t
2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 ↑ +2H 2 O
Нашатырь + гашеная известь
Mg 3 N 2 + 6H 2 O=3Mg(OH) 2 +2NH 3 ↑

Химические свойства
NH 3
-3
NH 3 – низшая степень окисления азота.
- Аммиак – восстановитель
2. Основные свойства
(неподеленная пара электронов)
3. Специфические свойства

Аммиак-восстановитель
NH 3
- Реакция горения аммиака (до N 2 ) :
4NH 3 + 3O 2 = 2N 2 + 6H 2 O
=

Аммиак-восстановитель
NH 3
- Каталитическое окисление аммиака ( до NO) :
4NH 3 + 5O 2 = 4NO + 6H 2 O

KMnO4
- Аммиаком можно восстановить
некоторые неактивные металлы:
3CuO + 2 NH 3 = 3Cu + N 2 + 3H 2 O
NH 3
- Аммиак обесцвечивает
перманганат калия:
2KMnO 4 +2 NH 3 = 2 KOH+N 2 + 2H 2 O +2MnO 2
Br 2
I
- Аммиак обесцвечивает
бромную воду:
3Br 2 + 8NH 3 = N 2 + 6NH 4 Br
цвет

Основные свойства
NH 3
Взаимодействие с водой
- Аммиак реагирует с водой, образуя гидрат аммиака ( аммиачная вода):
NH 3 + H 2 O = NH 4 OH
Изменяет окраску индикаторов :
Фенолфталеин – б / цв малиновый
Лакмус становится синим
Гидроксид аммония проявляет
все свойства щелочей !!!

Основные свойства
NH 3
Взаимодействие с кислотами
NH 3 + HCl → NH 4 Cl
хлорид аммония (нашатырь)
2 NH 3 + H 2 SO 4 → ( NH 4 ) 2 SO 4
сульфат
аммония
Дым без огня ?!
(Образуется за счет
образования
хлорида аммония)
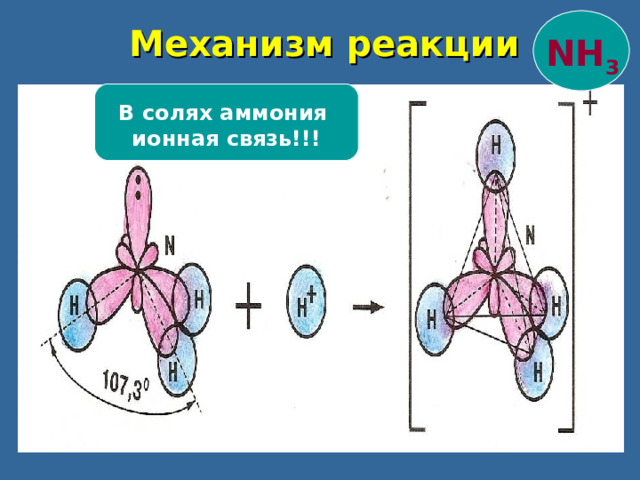
Механизм реакции
NH 3
В солях аммония
ионная связь!!!
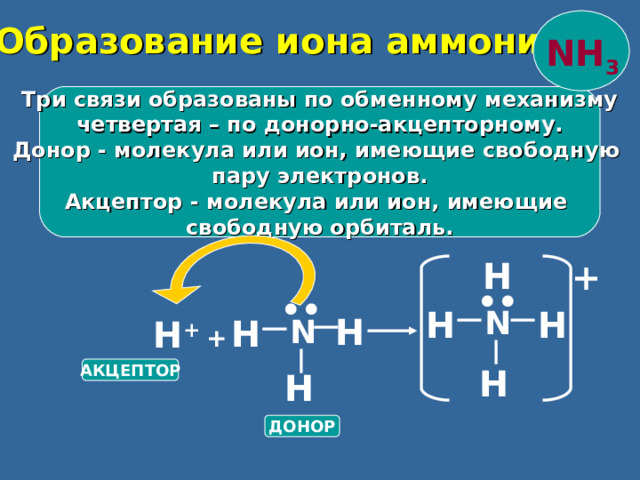
Образование иона аммония
NH 3
Три связи образованы по обменному механизму
четвертая – по донорно-акцепторному.
Донор - молекула или ион, имеющие свободную
пару электронов.
Акцептор - молекула или ион, имеющие
свободную орбиталь.
H
+
••
••
H
H
N
H
H
N
H +
+
H
АКЦЕПТОР
H
ДОНОР

Специфические свойства
NH 3
1 . Взаимодействие с гипохлоритом натрия
(образование гидразина):
2NH 3 + NaClO = N 2 H 4 + NaCl+H 2 O
Гидразин используют для
получения
ракетного топлива

Специфические свойства
NH 3
2. Взаимодействие с активными металлами
(образование амидов):
2NH 3 + 2К = 2KNH 2 + Н 2
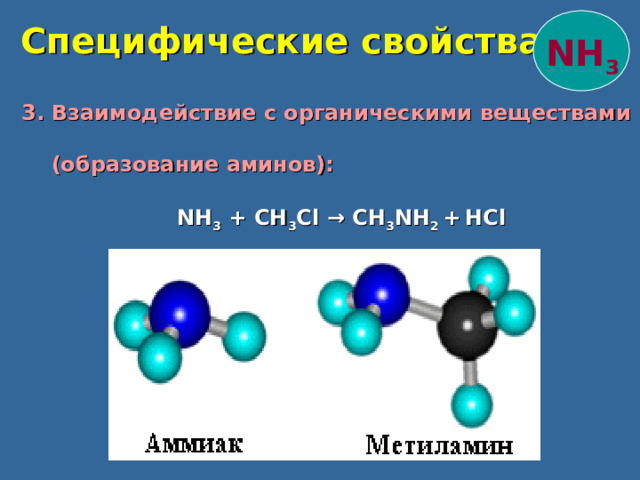
Специфические свойства
NH 3
3. Взаимодействие с органическими веществами
(образование аминов):
NH 3 + CH 3 Cl → CH 3 NH 2 + HCl
![Специфические свойства NH 3 4. Комплексообразование: CuSO 4 + 4NH 3 → [C u (NH 3 ) 4 ]SO 4 Cu ( OH) 2 + 4NH 3 → [C u (NH 3 ) 4 ] ( O H) 2 Благодаря своим электронодонорным свойствам, молекулы NH 3 могут входить в качестве лиганда в комплексные соединения.](https://fsd.videouroki.net/html/2024/04/08/v_6613799cc72e3/img26.jpg)
Специфические свойства
NH 3
4. Комплексообразование:
CuSO 4 + 4NH 3 → [C u (NH 3 ) 4 ]SO 4
Cu ( OH) 2 + 4NH 3 → [C u (NH 3 ) 4 ] ( O H) 2
Благодаря своим электронодонорным свойствам,
молекулы NH 3 могут входить в качестве лиганда
в комплексные соединения.

Обобщение
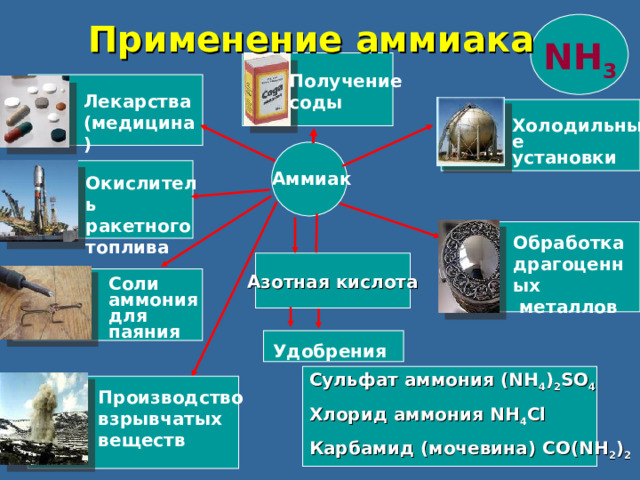
Применение аммиака
NH 3
Получение
соды
Лекарства
(медицина)
Холодильные
установки
Аммиак
Окислитель
ракетного
топлива
Обработка
драгоценных
металлов
Азотная кислота
Соли
аммония
для
паяния
Удобрения
Сульфат аммония (NH 4 ) 2 SO 4
Хлорид аммония NH 4 Cl
Карбамид (мочевина) CO(NH 2 ) 2
Производство
взрывчатых
веществ

Техногенные катастрофы
NH 3

Отравление аммиаком
NH 3
ПДК аммиака составляет 0,001 мг/л .
1. Нельзя прикасаться к разлитому веществу, это может вызвать болезненный ожог кожных покровов.
2. При отравлении аммиаком нельзя пить, а нужно закапать в глаза альбуцид или промыть глаза раствором борной кислоты.
3. В нос закапать теплое подсолнечное, оливковое или персиковое масло, а лицо, руки и вообще пораженные участки тела промыть 2-процентным раствором борной кислоты.

Проверь себя
NH 3
?
Для аммиака характерны свойства:
Аммиак взаимодействует с:
Цвет лакмуса в растворе аммиака:
Аммиак –
восстановитель в реакции
1
2
Ошибка
кислот
солей
Ошибка
Ошибка
Правильно!
щелочами
кислотами
Правильно!
Ошибка
неметаллами
металлами
Ошибка
оснований
оксидов
Ошибка
4
3
фиолетовый
красный
С кислотами
с неметаллами
Ошибка
Ошибка
Ошибка
Ошибка
Ошибка
Правильно!
С оксидами
металлов
С металлами
синий
Правильно!
бесцветный
Ошибка

Ответы
NH 3
1.
2.
3.
4.
оснований
кислотами
синий
С оксидами
металлов

Готовимся к экзамену
NH 3
- Осуществите цепочку превращений:
N 2 NH 3 (NH 4 ) 2 SO 4 NH 4 Cl NH 3 N 2 Li 3 N NH 3
Запишите уравнения реакций.
Где возможно, рассмотрите с точки зрения
ТЭД и ОВР.
Приведите электронный баланс, полные и
сокращенные ионные уравнения.

Готовимся к экзамену
NH 3
- Решите задачи:
Уровень А:
Какой объем аммиака можно получить при нагревании
7,4 г. гидроксида кальция с хлоридом аммония ?.
Уровень В:
Аммиак объемом 4,48 л (н.у) сожгли в равном объеме кислорода. Определите массу полученного азота.
Уровень С:
Аммиак объемом 2,24 л (н.у) пропустили в раствор фосфорной кислоты массой 100 г с массовой долей кислоты 19,8%. Определите состав соли и ее массовую долю в полученном растворе.

Кроссворд
NH 3
По горизонтали:
2. Название взрывчатых веществ, полученных на основе солей аммония…
3. Ученый, впервые получивший чистый аммиак…
4. Продуктом взаимодействия аммиака с кислотой является…
5. Аммиак и его водный раствор представляют собой слабую…
6. Название 10%-го раствора аммиака – нашатырный…
7. Аммиак в реакциях с водой и кислотами образует ион…
По вертикали:
1. Латинское название азота…
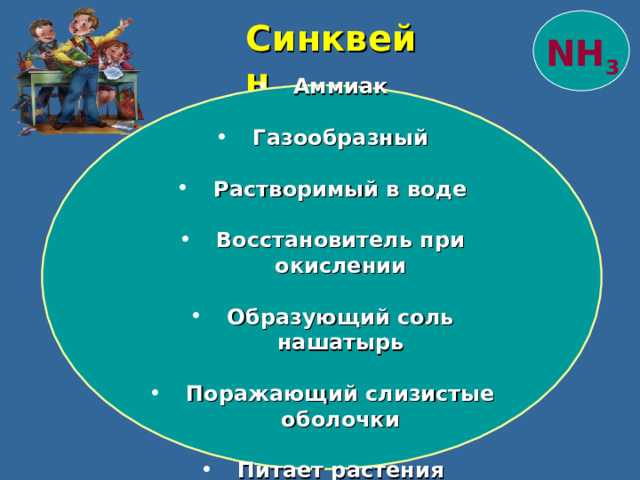
Синквейн
NH 3
- Аммиак
- Газообразный
- Растворимый в воде
- Восстановитель при окислении
- Образующий соль нашатырь
- Поражающий слизистые оболочки
- Питает растения


 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация Аммиак (5.36 MB)
Презентация Аммиак (5.36 MB)
 0
0 58
58 21
21 Нравится
0
Нравится
0


