ГБОУ ПК
«Школа – интернат для детей с нарушением зрения»
г. Пермь
|
|
Работу выполнила ученица 11 класса Буркова Надежда Руководитель: Л.Ю. Захарова, учитель химии
|
2017г.
СОДЕРЖАНИЕ
|
| ВВЕДЕНИЕ
| 3 |
| I | ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ | 4 - 9 |
| 1. | Кто открыл перекись водорода? |
|
| 2. | Получение |
|
| 3. | Строение молекулы |
|
| 4. | Физические свойства |
|
| 5. | Химические свойства |
|
| 6. | Бактерицидные свойства
|
|
| II | ПРИМЕНЕНИЕ ПЕРОКСИДА ВОДОРОДА | 10 - 17 |
| 1. | В промышленности |
|
| 2. | В медицине - польза - вред |
|
| 3. | В быту |
|
| 4. | На даче
|
|
| III | ИССЛЕДОВАТЕЛЬСКАЯ ЧАСТЬ | 18 - 22 |
| 1. | Влияние некоторых неорганических веществ на процесс разложения пероксида водорода |
|
| 2. | Проверка каталитических свойств активированного угля |
|
| 3. | Влияние некоторых органических веществ и пищевых продуктов на процесс разложения пероксида водорода |
|
| 4. | Исследование каталитических свойств ягод в процессе разложения перекиси водорода |
|
| 5. | Обесцвечивание разноцветной бумаги |
|
| 6. | Занимательный опыт «Много пены из ничего»
|
|
|
| ЗАКЛЮЧЕНИЕ
| 23- 24 |
|
| ИСТОЧНИКИ ИНФОРМАЦИИ | 25 |
ВВЕДЕНИЕ
Наверное, нет человека, который бы хоть раз в жизни не сталкивался с перекисью водорода, ведь небольшие бутылочки из темного стекла есть в каждой аптечке. Поэтому в ответ на вопрос: «Что собой представляет эта жидкость?», каждый сможет её описать – бесцветная, без запаха, почти как вода. И, конечно, все знают, что этот 3%-ный раствор перекиси водорода применяют при первичной обработке ран в качестве бактерицидного средства. Раны и царапины обеззараживают этим препаратом каждому с детства.Я, как человек занимающийся спортом, не раз получала травмы и пользовалась перекисью водорода. Но как-то встретила информацию о лечении многих болезней при приёме этого препарата по каплям внутрь. Безвредно ли это? С другой стороны, мне стало интересно, есть ли у перекиси водорода другие области применения? Так вырос интерес, и появилась цель.
Цель работы – изучить теоретические сведения о перекиси водорода, механизм действия этого вещества на здоровье человека.
Задачи:
1. Найти ответы на вопросы:
- кто впервые открыл перекись водорода,
- встречается ли она в природе,
- как её получают в промышленности,
- каково строение молекулы перекиси водорода,
- каковы физические, химические и бактерицидные свойства.
2. Узнать, как применяется перекись водорода в медицине и в других областях человеческой деятельности.
3. Разработать советы по использованию этого вещества в быту.
4. Выполнить практическое исследование:
- проверить некоторые химические свойства перекиси водорода;
- исследовать влияние различных катализаторов на процесс разложения перекиси водорода и на скорость образования кислорода;
- исследовать действие перекиси водорода на некоторые продукты питания;
- сделать возможные занимательные опыты с участием перекиси водорода.
5. Найти объяснение всем экспериментальным результатам.

I. ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
1. Кто открыл перекись водорода?
Интересно, откуда взялась перекись водорода, ведь в природе вещества с химической формулой H2O2, как долго считалось, не существует…
История перекиси началась почти 200 лет назад, в далеком 1818 году, когда француз Луис Тенаро, проводя химические опыты с разными веществами, решил соединить пероксид бария и серную кислоту. В результате этой химической реакции было получено вещество, очень похожее на обычную воду, но отличавшееся от воды тем, что было в полтора раза тяжелее, испарялось заметно медленнее и в любых пропорциях могло растворяться в обычной воде. Новое вещество получило название «окисленная вода».
Полученную случайно «окисленную воду» позже назвали перекисью водорода, а современное название – пероксид водорода.
|
| Луи Жак Тенар (1777 – 1857) Французский химик, член Парижской Академии наук (1810), её Президент (с 1823г.), профессор Парижского университета. Л. Тенар — автор многочисленных работ в области химии и химической технологии: открыл способ получения калия и натрия восстановлением их гидроксидов, получил бор из борного ангидрида, обнаружил действие света на реакцию хлора с водородом, предложил метод анализа органических веществ, доказал, что натрий, калий и хлор — элементы, открыл пероксид водорода. |
Луи Тенар заинтересовался нестабильным и легко распадающимся веществом и продолжил эксперименты. Он установил формулу полученного продукта Н2О2 и выяснил, что оно получается и при действии других кислот на пероксид бария:
BaO2 + 2HCl = BaCl2 + H2O2
Тенар также обнаружил каталитическое действие твердых тел на разложение пероксида водорода, и с тех пор эта реакция служит эталонной для определения каталитической активности различных веществ.
Промышленное производство перекиси водорода началось в 1873 году в Берлине, однако срок годности полученной в итоге жидкости оставался очень маленьким и не превышал двух недель.
2. Получение
Не так давно выяснилось, что перекись водорода – это совсем не искусственное соединение, которое можно получить только химическим путём в лабораторных условиях.
Природа вокруг нас содержит это соединение в значительных количествах.
Перекись водорода содержится в дождевой воде и снеге, где она образуется из атмосферного озона, в горном воздухе. Туристы, путешествующие в горах, знают, что лучше пить воду из потоков, в которых вода белая от многочисленных пузырьков кислорода.
Но, естественно, никто не догадывается, что во многом этот белый цвет обусловлен наличием в такой воде перекиси водорода, образующейся в воде из-за усиления её аэрации. В такой воде количество вредных микробов и паразитов крайне мало, такую воду можно пить без дополнительного кипячения или обработки специальными препаратами.
Пероксид водорода всегда образуется во влажной атмосфере при электрическом разряде. Он также образуется как побочный продукт при окислении многих веществ кислородом воздуха.
Пероксид водорода частично образуется в пламени горящего водорода, но при остывании продуктов сгорания разлагается. В довольно больших концентрациях (до нескольких %) Н2О2 получен взаимодействием водорода в момент выделения с молекулярным кислородом. Пероксид водорода частично образуется при нагревании до 2000˚С влажного кислорода, при прохождении тихого электрического разряда сквозь влажную смесь водорода с кислородом и при действии на воду ультрафиолетовых лучей или озона.
В промышленности пероксид водорода получают при реакции с участием органических веществ, в частности каталитическим окислением изопропилового спирта:
(CH3)2СН(ОН) + O2 → CH3C(O)CH3 + H2O2
Ценным побочным продуктом этой реакции является ацетон.
Более современным методом получения пероксида водорода является взаимодействие с водой надсерной кислоты (или некоторых её солей), при котором надсерная кислота гидролизуется:
Н2S2O8 + 2H2O = 2H2SO4 + Н2О2
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
В лабораторных условиях для получения пероксида водорода используют реакцию действия на пероксид бария разбавленной серной кислотой:
BaO2 + H2SO4 → H2O2 + BaSO4
При этом наряду с пероксидом водорода образуется нерастворимый сульфат бария, от которого жидкость может быть отделена фильтрованием.
Формы выпуска. Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. В аптеках Н2О2 продается обычно в виде 3%-ного водного раствора.
30 %-ный водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем. 
Ежегодное мировое производство Н2О2 превышает 100 тыс. тонн.
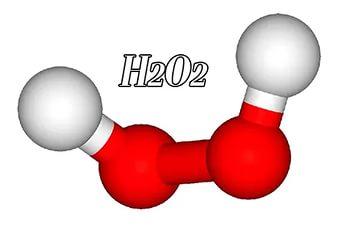
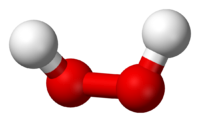
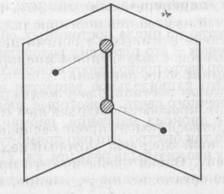
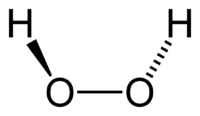
3. Строение молекулы
Структурная формула пероксида водорода Н-О-О-Н показывает, что два атома кислорода непосредственно соединены друг с другом. Связь эта непрочна и обусловливает неустойчивость молекулы. И это неудивительно. В молекуле пероксида водорода кислород находится в очень неустойчивой нечетной степени окисления -1.
Молекула пероксида водорода не линейна, имеет забавную форму – она похожа на полураскрытую книгу, где атомы кислорода находятся как раз на корешке, а атомы водорода на страницах…
|
|
|
|
Вследствие несимметричности молекула H2O2 сильно полярна. Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также (как вода) способна образовывать донорно-акцепторные связи.
4. Физические свойства
Перекись водорода – это бесцветная (в больших объемах чуть синеватая) прозрачная, слегка вязкая жидкость со слабым своеобразным запахом, с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Молекулярная масса пероксида водорода 34, почти в 1,5 раза больше, чем у воды.
Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2О2•2H2O.
Чистый пероксид водорода имеет плотность около 1,5г/мл, кипит при 150˚С. Молекулы ассоциированы, подобно воде. Замерзание сопровождается сжатием (в отличие от воды) и превращением в белые кристаллы. Точка замерзания -0,5˚С, т.е. чуть ниже образования льда.
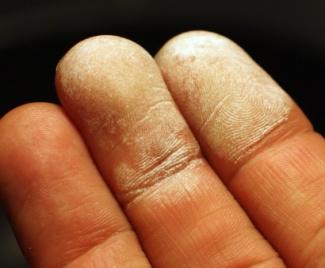
При действии на кожу крепких растворов (пергидроля) получаются ожоги, причем обожженное место окрашивается в белый цвет.
Используется Н2О2 чаще всего в виде 3%-го водного раствора, который по свойствам значительно отличается от чистого пероксида водорода.
H2O2 — простейший представитель пероксидов, солей пероксида водорода. 
Пероксиды металлов Me2O2 – твердые вещества, растворимые в воде, имеет окраску от светло-желтого у Na2O2 – до темно-коричневого у Rb2O2.
5. Химические свойства
1. Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов и серебра:
2H2O2 → 2H2O + O2
Разложение пероксида водорода идёт быстрее при нагревании и на свету. Поэтому хранить его следует в тёмном прохладном месте. Однако очень чистый пероксид водорода устойчив.
2. Пероксид водорода проявляет слабые кислотные свойства, и поэтому диссоциирует по двум ступеням:
Н2О2 ↔ Н+ + НО2-
НО2- ↔ Н+ + О22-
3. При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов (соли пероксида водорода Li2O2, MgO2 и др.):
Н2O2 + 2NaOH → Na2O2 + 2H2O
H2O2 + Ba(OH)2 → BaO2↓ + 2H2O
Как двухосновная кислота Н2О2 образует не только cредние соли (пероксиды), но и кислые (Ва(НО2)2, NaHO2 и др.) Кислые соли менее подвержены гидролизу, но легко разлагаются при нагревании с выделением кислорода:
2NaHO2 → 2NaOH + O2.
Выделяющаяся щелочь, как и в случае Н2О2, способствует разложению.
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. Кроме пероксидов металлов к ним относятся кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидисерная H2S2O8 кислоты.
4. Пероксид водорода является сильным окислителем, т.е. легко отдаёт свой лишний (по сравнению с более устойчивым соединением – водой) атом кислорода. Так, при действии безводной и даже высококонцентрированной Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются.
Характерный для пероксида водорода окислительный распад может быть схематично изображён так:
Н2О2 = Н2О + О
Кислая среда более благоприятствует этому распаду, чем щелочная:
| Среда | Н2О2 - окислитель |
| кислая | Н2О2 + 2Н+ + 2ē → 2Н2О |
| щелочная | Н2О2 + 2ē → 2ОН- |
| нейтральная | Н2О2 + 2ē → 2ОН- |
Пероксид водорода окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Вот некоторые уравнения химических реакций:
2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
PbS + 4H2O2 = PbSO4 + 4H2O
KNO2 + H2O2 = KNO3 + H2O
H2O2 + 2HCl = 2H2O + Cl2
H2O2 + 2KI + H2SO4 = I2 + K2SO4
Растворы Н2О2 обесцвечивают многие органические соединения, например, индиго. Это также связано с окислительным действием.
5. При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
O22− — 2e− → O2
В кислой среде восстановительный распад идет труднее, щелочная среда более благоприятствует такому распаду.
| Среда | Н2О2 - восстановитель |
| кислая | Н2О2 - 2ē → О2 + 2Н+ |
| щелочная | Н2О2 + 2ОН- - 2ē → О2 + 2Н2О |
Восстановительный распад пероксида водорода имеет место, например, в присутствии оксида серебра:
Ag2O + H2O2 = 2Ag + H2O + O2
Аналогично, по существу, протекает его взаимодействие с озоном и с перманганатом калия в кислой среде:
O3 + H2O2 = H2O + 2O2
2KMnO4 + 4H2O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5O2 + 8H2O
Последняя реакция применяется в химическом анализе для количественного определения содержания Н2O2.
6. Пероксиды щелочных металлов являются сильными окислителями. Реакции со многими веществами (порошкообразный Al, уголь, эфир, хлопок и др.) происходят настолько энергично, что сопровождаются взрывом.
Пероксид натрия получают СО2 с выделением кислорода:
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Это свойство используется в дыхательных аппаратах для водолазов и пожарных, а также для обновления воздуха в закрытых помещениях, в частности, на подводных лодках.
6. Бактерицидные свойства
Перекись водорода обладает универсальным противомикробным действием. К ней чувствительны грамположительные и грамотрицательные бактерии, вирусы, многие виды патогенных грибов. Вызывает гибель спор большинства спорогенных бактерий. Противомикробное действие Н2О2 связано с ее высокой окислительной активностью.
2Н2О2 = Н2О + О2↑
При контакте с живыми тканями пероксид водорода разлагается с выделением кислорода. Отсюда его противомикробное действие.
Выделяющийся при ее разложении микробными и тканевыми протеазами кислород окисляет сульфгидрильные и гидроксильные группы белков и липидов, вызывая гибель микробов.

II. ПРИМЕНЕНИЕ ПЕРОКСИДА ВОДОРОДА
В промышленности
Безусловно, такой уникальный окислитель, как перекись водорода, используется в самых разных промышленных отраслях и в самых разных сферах повседневной жизни.
Целлюлозно-бумажная и текстильная промышленность - самая большая область применения перекиси водорода в качестве отбеливающего вещества. Химикат используется, как при отбелке химической массы (сульфатной и сульфитной), так и при отбелке различных типов механической массы, также для регенерации макулатуры. Перекись водорода используется в текстильной промышленности, как эффективное отбеливающее средство для хлопка, текстиля, шерсти, мехов, различных искусственных и синтетических волокон.
Почему же промышленность предпочитает использовать для отбеливающих процедур именно перекись водорода? Дело в том, что этот окислитель обладает очень мягким действием и не оказывает никакого вредного влияния непосредственно на материал, который отбеливается, то есть не повреждает его структуру.
Еще одна важная особенность — это то, что применение для отбеливания перекиси водорода не наносит никакого вреда для окружающей среды, то есть использование этого вещества не способно ухудшать экологическую ситуацию. Ведь отбеливание, по сути, производится при помощи кислорода, поэтому ни загрязнения атмосферы, ни загрязнения водных ресурсов просто невозможны. Именно поэтому многие производства, в том числе и целлюлозные комбинаты, отказались от отбеливания своей продукции при помощи хлора, который использовался с этой целью раньше. 
Химическая промышленность использует перекись водорода для промышленного синтеза неорганических и органических химических веществ, при производстве полимерных материалов, в том числе и некоторых пористых веществ. В аналитической химии пероксид водорода используется в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. Пероксид водорода находит также своё применение в качестве катализатора и гидрирующего агента.
Металлургическая промышленность применяет Н2О2 для обработки металлических поверхностей, для очистки, травления, полировки или пассивации ряда металлов и сплавов; для извлечения из руд ценных металлов (например, урана путем перевода его нерастворимой формы в растворимую).
Электронная промышленность использует Н2О2 в производстве печатных плат и в обработке кремниевых подложек при производстве полупроводниковых чипов.
Ракетостроение, самолетостроение, космонавтика. Перекись водорода необходим как источник кислорода в условиях отсутствия воздуха, а также как источник энергии при быстром взлете самолетов и ракет. Применяется как ракетное топливо, в качестве окислителя или как однокомпонентное топливо (с разложением на катализаторе), в том числе для привода турбонасосных агрегатов.
Интересно, что во время Второй мировой войны немецкие ученые смогли создать истребитель, развивающий скорость почти до тысячи километров в час и работающий на веществе, которое получалось в результате химической реакции перекиси водорода и метанола.
Сельское хозяйство. Для сохранения семян и ускорения их прорастания в процессе соложения.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией, для очистки инструментов и оборудования. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для стерилизации продуктовой упаковки. В винодельческой промышленности перекись водорода с успехом используется для быстрого искусственного старения вин.
Незаменима перекись водорода в области защиты окружающей среды. Она применяется для очистки и обеззараживания промышленных сточных вод, для биорегенерации загрязненных земель, являясь универсальным агентом для обезвреживания различных токсичных веществ в промышленных и бытовых сточных водах, в газовых выбросах. С её помощью могут обезвреживаться сульфиты и сульфиды, гипохлориды, нитриты, нитрилы, цианиды, альдегиды, фенолы, гидразины, эфиры и др. Применяя перекись водорода, можно эффективно очищать различные отходящие газы от двуокиси серы, оксиды азота, сероводорода, хлора, синильной кислоты.
В медицине
а) польза
Обработка ран. В медицине перекись водорода нашла применение благодаря наличию у неё антисептического, дезодорируещего и кровоостанавливающего свойства. Применяют для обработки ран, ссадин, царапин, остановки носовых и других небольших капиллярных кровотечений, в виде полосканий при ангине и стоматите.
Обеззараживающий (антисептический) эффект объясняется тем, что при контакте перекиси водорода с кожей под влиянием фермента крови каталазы происходит распад Н2О2, высвобождение кислорода (появляется пенка). Как следствие, рана получает возможность очиститься механическим способом — образовавшаяся кислородная пена очищает рану просто механически, вымывая микробы, грязь и даже некротические образования, которые могли уже появиться в ране.
Однако такое действие непродолжительно и обладает слабым эффектом.
Тем не менее, перекись водорода 3 % очень эффективна для лечения небольших царапин, особенно у детей — она не «щиплет», не имеет запаха, бесцветна. Однако она может вызывать небольшое жжение в районе открытой раны.
Обладая хорошими очищающими свойствами, пероксид водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, наоборот, продлевают время заживления из-за повреждения прилегающих к ране клеток. Более того, пероксид водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. Однако, в качестве средства для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена, пероксид водорода остаётся предпочтительным препаратом. Он позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки пероксидом водорода антисептический раствор не сможет удалить эти патологические образования, что приведет к значительному увеличению времени заживления раны и ухудшит состояние больного. 
Следует только помнить, и это написано в инструкции по применению, что сразу после обработки перекисью нельзя накладывать повязку, рана должна быть хорошо промыта и высушена.
Внимание! Пока медицина не может отказаться от использования перекиси водорода для процесса качественной обработки ран, особенно если дело касается ран сложных, глубоких или любых гнойных — именно в таких случаях перекись (пероксид) водорода остается препаратом первого выбора. Надо помнить, что обрабатывать раневые поверхности перекисью водорода следует очень аккуратно, поскольку Н2О2 не только убивает бактерии, но способна уничтожать и живые клетки организма, тем самым разрушая защитный слой кожи. Кожа становится уязвимой для воздействия вредоносных микроорганизмов: микробов, вирусов и бактерий.
Простые и неглубокие раны обработки перекисью водорода не требуют — для их обработки можно использовать другие антисептические (обеззараживающие) средства.
Остановка носового кровотечения. Каждому надо знать, как поступить, если вдруг пошла кровь из носа: надо сесть на стул, сделать холодный компресс на лицо, а затем аккуратно ввести в ноздри ватные тампоны, смоченные слабым раствором пероксида водорода. Если всего этого окажется недостаточно, надо обратиться к врачу.
Полоскания перекисью водорода. Дезинфицирующие и очищающие свойства перекиси водорода широко применяются в различных сферах медицины, в том числе и в ЛОР-практике при лечении болезней горла.
Врачи-отоларингологи часто рекомендуют перекись водорода при лечении таких заболеваний, как ангина (особенно для лечения гнойной ангины); фарингит, простудные заболевания, при которых повреждается горло, а также при лечении стоматитов различной этиологии, Это помогает ускорить процесс выздоровления, а заодно избавиться от неприятного запаха.
Все перечисленные заболевания объединяет одна особенность — на слизистой оболочке поверхности горла или ротовой полости могут образовываться ранки, в которых собирается гнойное содержимое, а также небольшое количество крови и некоторые вещества, имеющие белковую природу. Во время полоскания раствором Н2О2, т. е. при контакте этого вещества с поврежденными поверхностями, начинается высвобождение кислорода и образуется пена; в результате этого происходит механическое избавление от гнойного содержимого, от крови и любых содержащихся в ране веществ белковой природы, которые мешают заживлению раны и выздоровлению. Очень эффективна перекись водорода, если возникает необходимость убрать налет с поверхности миндалин в горле.
Однако при полоскании горла с использованием перекиси водорода следует соблюдать некоторые правила:
Правило 1. Предварительно перекись водорода 3 % необходимо развести в воде (1 столовая ложка на 100г воды). Это обязательно, т.к. неразведенной перекисью можно повредить горло еще сильнее, что потребует длительного и сложного лечения. Как вариант можно использовать таблетки гидроперита - соединение пероксида водорода с карбамидом - мочевиной, состава (NH2)2CO • Н2О2. Одну таблетку этого вещества необходимо растворить в 200мл кипяченой и охлажденной воды.
Правило 2. Полоскать горло раствором перекиси водорода можно не чаще, чем один раз в 3 часа. Всего в течение дня следует проводить 4-5 полосканий.
Правило 3. После полоскания горла и полости рта раствором перекиси водорода необходимо немедленно прополоскать горло и полость рта другим раствором, чтобы вымыть пену, в которой уже растворились инфекционные агенты и чтобы полностью очистить горло.
Внимание! Перекись водорода — это очень сильный окислитель, и даже использование растворов требуют повышенной осторожности. Если при помощи раствора перекиси водорода проводится полоскание горла, то следует помнить, что глотать этот раствор ни в коем случае нельзя. Для маленьких детей полоскание горла при помощи перекиси водорода совершенно недопустимо!
Применение внутрь. Некоторые люди, в том числе и медицинские работники, считают, что может быть полезным употребление перекиси водорода 3 % внутрь. В качестве объяснения выдвигается аргумент, что любые клетки организма человека постоянно нуждаются в кислороде, а именно кислород и высвобождается во время распада перекиси. Есть рекомендации для лечения самых различных заболеваний: от кариеса до рака легких. Перекись водорода применяли даже для лечения легких, сердца, кожи и других. И в некоторых случаях такое лечение действительно приводило если не к полному излечению, то к улучшению состояния здоровья пациента.
Но есть и противники этого метода. Они говорят о том, что при распаде перекиси водорода в организм попадает не только молекулярный кислород, но и свободные радикалы, которые способны разрушающе действовать на любые белковые образования в организме и даже разрушительно действовать на клеточную структуру. Исследователи сообщают, что именно свободные радикалы, которые находятся в организме, способны стать причиной развития очень серьезных заболеваний, в том числе атеросклероза, диабета и даже онкологических заболеваний.
Отбеливание зубов. Долгое время считалось, что перекисью водорода можно отбеливать зубы, но специалисты это делать категорически не рекомендуют, поскольку отбеливающий эффект основан на окислительных процессах, которые неминуемо приводят к разрушению тканей, в том числе и тканей зуба.

6. Косметология. Со свойством перекиси водорода окислять красители связано и использование её в парикмахерском искусстве. Именно благодаря гидропериту многие дамы смогли достигнуть заветной мечты – стать блондинкой. И хотя сейчас появилось много всевозможных красителей, перекись водорода остается наиболее дешевым и эффективным средством обесцвечивания волос.
Иногда можно перекись можно использовать для борьбы с прыщами, но в использовать её в этом случае надо точечно и не применять ежедневно и длительное время.
в) вред
Когда люди с восторгом используют полезные свойства перекиси, то часто забывают, что это вещество может быть не только полезным, но и опасным, поскольку представляет собой очень сильный окислитель. Не мешает обратить внимание, в какой пропорции следует разводить 3%-ный раствор перекиси, а это значит, что не такое уж и безопасное это вещество.
Конечно, если перекись водорода использовать только для обработки раневых поверхностей, то особых проблем не предвидится. Главное тут не переусердствовать и не обрабатывать рану слишком активно или слишком часто.
Однако кое-кто считает, что организму просто необходим прием перекиси водорода внутрь и что именно это простое средство может стать панацеей от всех болезней, поскольку кровь, таким образом, может получить дополнительный кислород. Так ли это на самом деле?
Нет. Перекись водорода — это мощнейший окислитель и даже для наружного применения его используют в очень сильном разведении. Концентрированные растворы пероксида водорода очень опасны – при попадании на кожу они становятся причиной серьезных ожогов. А чистый пероксид водорода - это взрывоопасное вещество, способное одномоментно выделять большие количества свободного кислорода.
Прием этого вещества (даже слабой концентрации) может стать причиной весьма негативных явлений, среди которых рвота, тошнота, кожная сыпь и другие аллергические реакции, возможны нарушения сна и другие неврологические симптомы.
Концентрированные растворы перекиси водорода (30%) приводят к серьезным разрушающим изменениям в организме, включая летальный исход.
3. В быту
Что касается использования перекиси водорода в быту, то это вещество известно как очень эффективное чистящее средство. При помощи перекиси водорода можно очищать сантехнические раковины, поверхности труб и даже мебельные поверхности.
Перекись водорода отлично зарекомендовала себя как средство для стирки и качественного отбеливания белых вещей, для выведения пятен на тканях. Обращаться с ней надо очень аккуратно, ведь перекись водорода - сильнейший окислитель. Попадая на кожу рук, вызывает сильные ожоги. Особенно надо беречь глаза. В последнее время появилось немало средств для стирки на кислородной основе, в которых работает все та же перекись водорода. Такая стирка гораздо эффективнее, безопаснее, ткани сохраняются дольше, а неприятный запах, как при отбеливании хлором, отсутствует вообще.
Многие хозяйки используют перекись водорода как прекрасно зарекомендовавшее себя средство для мытья пола — для этого в четырех литрах воды следует растворить около трети или четверти стакана (100-150 г) перекиси.
Рекомендовано использование перекиси водорода для мытья сантехники, особенно туалета. Для того чтобы туалет стал действительно чистым, следует смешать в равной пропорции перекись водорода и чистую воду и распылить полученную смесь на поверхность унитаза, после чего все смыть водой. Любые микробы не выдерживают контакта с пероксидом водорода.
Перекись водорода может пригодиться для поддержания необходимой чистоты и для обеззараживания зубной щетки, на поверхности которой могут собираться самые разные болезнетворные микробы. Чтобы избавиться от ненужных микроорганизмов, зубную щетку полезно время от времени подержать в трехпроцентном растворе перекиси водорода (в течение не более двух минут), а затем тщательно прополоскать проточной водой.
Если в жилище появились грибок и плесень, то бороться с ними тоже можно при помощи все той же перекиси. Чтобы получить положительный результат, необходимо в бытовой распылитель налить две части воды и одну часть перекиси (по объему) и распылить смесь на зараженную грибком поверхность. Через 10 минут поверхность необходимо тщательно очистить.
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме.
Пригодится перекись водорода и на кухне, чтобы сохранить подольше некоторые продукты. Для этого перекись водорода следует смешать с водой в равной пропорции и побрызгать из распылителя фрукты и овощи, которые затем следует тщательно помыть в проточной воде. Обработанные таким образом продукты будут храниться более длительное время.
Перекись водорода вещество отлично зарекомендовало себя при мытье посуды. Для этого в раковину с водой следует добавить около 100 г перекиси и дальше мыть посуду, как обычно.
Очень полезно перекисью водорода обрабатывать разделочные доски, особенно для рыбы и мяса — такая обработка уничтожит на досках все опасные микроорганизмы, вирусы и бактерии, включая сальмонеллу, которая очень опасна для здоровья.
Для поддержания чистоты кухонной губки ее также следует опускать в такой же (1:1) раствор перекиси водорода. Затем губку следует тщательно прополоскать и высушить, и уже только потом продолжать использовать.
4. На даче
Что касается применения перекиси водорода на дачных участках, то, конечно же, это средство необходимо для обработки полученных травм, которые на даче весьма вероятны.
Но применение этого средства в дачных условиях не ограничивается только медицинскими целями.
Опытные огородники утверждают, что полив растений слабым раствором перекиси водорода улучшает их рост и состояние. Для приготовления раствора для полива следует в 1л воды растворить 25г 3%-го раствора перекиси водорода. Полученное средство можно использовать также для того, чтобы опрыскивать деревья и кусты — так удается избежать многих заболеваний растений. Перекисной водой полезно опрыскивать и нездоровые садовые деревья.
Также опытные садоводы советуют замачивать в растворе перекиси водорода семена перед посадкой — для быстрейшего проращивания. Для раствора берут 25г 3%-го перекиси на 500 мл воды. Замачивать семена не более трех часов.
Еще один способ применить перекись водорода на дачном участке — приготовление кормов для животных. Ни для кого не секрет, что на приусадебных участках остается то ботва различных растений, то солома, то еще какие-то отходы. Выбросить все это жалко, а компостные ямы обустраивают далеко не все. Но превратить эти разнообразные остатки в питательный корм для домашних животных не так уж и сложно. Для этого нужно, например, солому или ботву замочить в растворе перекиси водорода. Несколько часов в таком растворе делает корм гораздо привлекательнее для домашних животных, поскольку он становится более питательным и переваривается значительно легче.
III. ИССЛЕДОВАТЕЛЬСКАЯ ЧАСТЬ
Цель исследования: Изучить свойства пероксида водорода, исследовать влияние различных катализаторов на процесс разложения этого вещества и на скорость образования кислорода.Оборудование и реактивы:
Спиртовка со спичками, деревянная лучинка, штатив с пробирками, 3%-ный раствор пероксида водорода, порошок диоксида марганца, ржавый гвоздь, медная проволока, кусочек мела, песок, древесный и активированный уголь, образцы пищевых продуктов – поваренная соль, сахар, крахмал, кусочек сырого мяса, ломтик яблока, картофеля, сырые ягоды, полоски фильтровальной бумаги.
Опыт 1. Влияние некоторых неорганических веществ
на процесс разложения пероксида водорода
Налили понемногу 3%-ного раствора пероксида водорода в 6 пробирок. Добавили: 1 - щепотку порошка диоксида марганца, 2 - ржавый гвоздь, 3 - медную проволоку, 4 – древесный уголь, 5 - кусочек мела, 6 - кварцевый (речной) песок. Наблюдали, в каких случаях происходит выделение кислорода? Свои наблюдения занесли в таблицу.
|
| Добавленное вещество | Наблюдения | Выводы |
| 1 | порошок MnO2 диоксида марганца (пиролюзит)
|
Выделение пузырьков газа | H2O2 → H2O + O; 2O → О2 Тлеющая лучинка вспыхивает, т. к. выделяется газ кислород. |
| 2 | ржавый гвоздь | ||
| 4 | древесный уголь | Вяло текущая реакция разложения Н2О2 | |
| 3 | медная проволока | Ничего не происходит |
|
| 5 | мел | ||
| 6 | кварцевый песок | ||
В 2-х случаях (с MnO2 и ржавым гвоздём) мы наблюдали выделение пузырьков газа. Для доказательства, что выделяющийся газ – кислород, мы в пробирку вносили тлеющую лучинку. Она разгоралась ярче, что говорит о выделении газа, поддерживающем горение, - это кислород. Особенно эффектно это проявилось в реакции разложения пероксида под действием порошка MnO2.
Вывод: вещества диоксид марганца (пиролюзит) и ржавчина на железе ускоряют разложение перекиси водорода. Они являются катализаторами разложения пероксида водорода. (Вещества, ускоряющее химические реакции называется катализаторами, от гр. кatalysis - разрушение).
|
|
|
| Объекты исследования | |
|
|
|
| Изменения, происходящие в пробирках | |
|
|
|
| Качественная реакция на кислород | |
Опыт 2. Проверка каталитических свойств активированного угля
Из научных источников я узнала, что уголь тоже может быть хорошим катализатором для разложения пероксида водорода. Но в предыдущем опыте наш древесный уголь реакции почти не проявил.
Я решила испытать аптечный активированный уголь. Кусочки угля 2-х разных производителей поместила в пробирку, добавила пероксид водорода (3%-й раствор). Пузырьки кислорода выделяются, вспыхивающая спичка это доказала. Причём лучше работает уголь иностранного производства по сравнению с российским углем (который дешевле). Значит, всё дело в качестве угля, и он также катализирует нашу реакцию.
| | | |
Опыт 3. Влияние некоторых органических веществ и пищевых продуктов на процесс разложения пероксида водорода
В 7 пробирок внесли небольшие образцы пищевых продуктов – поваренную соль, сахар, крахмал, кусочек вареного картофеля, сырого картофеля, сырого мяса, яблока. Прилили немного 3%-ного раствора пероксида водорода, наблюдения занесли в таблицу.
|
| Добавленное вещество | Наблюдения | Выводы | ||||
| 1 | поваренная соль |
Изменений не происходит |
| ||||
| 2 | сахар | ||||||
| 3 | крахмал | ||||||
| 4 | варёный картофель | ||||||
| 5 | сырой картофель | Выделение пузырьков газа и образование шапки пены | Тлеющая лучинка вспыхивает, т. к. выделяется газ, поддерживающий горение - кислород | ||||
| 6 | кусочек сырого мяса | ||||||
| 7 | ломтик яблока | ||||||
|
|
| ||||||
| Подготовка эксперимента | |||||||
|
|
| ||||||
| Видимые признаки реакции | |||||||
|
|
|
|
Образование обильной пены при разложении пероксида водорода под действием сырого картофеля, сырого мяса и свежего яблока | ||||
Вывод: В некоторых сырых продуктах питания (картофеле, мясе, яблоке и др.) содержатся катализаторы, разлагающие перекись водорода. Такие биологические катализаторы белковой природы называются ферментами.
Нагревание, кипячение, жарка уничтожают большую часть кислорода, поэтому, хотя приготовленные овощи и содержат некоторые витамины, по сути своей они «мертвы».
Опыт 4. Исследование каталитических свойств ягод в процессе разложения перекиси водорода
Для опыта взяты ягоды: клюква, смородина, облепиха, малина и черника. При добавлении к ягодам раствора 3%-ной перекиси водорода реакция не происходила.
|
|
|
В этом опыте я получила отрицательный результат. Проверяемые ягоды не содержат катализатора для разложения пероксида водорода. Они ценны другими, более полезными компонентами – витаминами.
Правда, по прошествии некоторого времени наблюдали осветление ягод, что объясняется обесцвечивающими свойствами перекиси водорода.
Опыт 5. Обесцвечивание разноцветной бумаги
Я приготовила две полоски фильтровальной бумаги и нанесла на них одинаковые метки разноцветными фломастерами. Одну такую полоску внесла в раствор пероксида водорода, вторую оставила для сравнения. Сравнила цвет меток на обеих полосках через 10 минут, через час.
|
|
|
Под действием перекиси водорода полоски быстро побледнели, затем исчезли совсем. |
Вывод: Пероксид водорода является окислителем, обесцвечивает многие красящие вещества, в том числе краситель фломастеров.
6. Занимательный опыт «Много пены из ничего»
Оборудование и реактивы: химические стаканы, лоток, 3%-й раствор перекиси водорода H2O2, жидкое мыло, раствор гидроксида аммония NH4OH, раствор сульфата меди CuSO4.
В один стакан налили немного жидкого мыла и раствор пероксида водорода. В другой стакан налили раствор медного купороса CuSO4, добавили избыток раствора аммиака. Первоначально образовавшийся голубой осадок Cu(OH)2 растворился и образовался ярко-синий раствор. Это комплексная соль гидроксид тетрааммин меди (II).
CuSO4 + 6NH3 + 2H2O = [Cu(NH3)4](OH)2 + (NH4)2SO4
Содержимое 2-го стакана перелили в 1-й стакан. Происходит бурная реакция пенообразования, причем пены так много, что стакан переполняется. Опыт очень эффектный и зрелищный!
|
|
|
Вывод. Комплексная соль меди является прекрасным жидким катализатором для разложения перекиси водорода:
2Н2О2 = 2Н2О + О2
Реакция разложения запускается быстро. Мыльный раствор не дает кислороду «улететь». Пузырьки выделившегося кислорода обволакиваются слоем молекул мыла и поднимаются на поверхность. Соприкасаясь друг с другом, они образуют ячеистую структуру – пену. Пена получается плотной и долго не оседает из-за низкого содержания воды.
ЗАКЛЮЧЕНИЕ
Открытая в далеком 1818 году французским химиком Луисом Тенаро перекись водорода имеет непростую и довольно занимательную судьбу. Сегодня она стала чем-то обыденным и привычным, является постоянным обитателем каждой домашней (и не только!) аптечки.
Я изучила большой объем научной литературы о пероксиде водорода, который по старинке называют «перекисью» водорода: строение, получение и свойства вещества, где оно находит применение.
В экспериментальной части мне удалось доказать, насколько это вещество нестойкое, легко разлагается под действием биологических катализаторов (ферменты мяса, яблока, сырого картофеля) и под действием некоторых химических веществ (уголь, оксид и гидроксид железа (III), оксид марганца (IV), комплексная аммиачная соль меди). Опытным путём я убедилась в окислительных обесцвечивающих свойствах перекиси водорода.
Меня поразил масштаб применения этого вещества!
Более половины всего вырабатываемого пероксида водорода расходуется на отбелку различных материалов. Важное преимущество пероксида водорода перед другими окислителями заключается в "мягкости" действия, благодаря чему сам отбеливаемый материал почти не затрагивается. С этим же связано и медицинское использование очень разбавленных растворов пероксида водорода в качестве антисептика.
Очень концентрированные (80% и выше) водные растворы Н2О2 находят применение в качестве источников энергии и как окислитель реактивных топлив. Пероксид водорода применяется как окислитель в химических производствах, как сырьё для получения пероксидных соединений, инициатор полимеризационных процессов, при изготовлении некоторых пористых изделий, для искусственного старения вин, крашения волос и т. д.
Я считаю, что перекись водорода должна быть всегда дома. Она незаменимый помощник для разного рода повреждений кожи, помогает промыть рану и немного приостановить кровотечение.
Хочу сделать акцент на то, что помимо основного назначения перекиси существует ещё множество способов применения этого прекрасного вещества в быту:
Перекись поможет удалить пятна с одежды и полотенец. Результат удивляет!
Добавляйте перекись в воду для мытья пола, и они будут блестеть!
Чтобы избавиться от неприятного запаха, убирая, используйте перекись водорода!
Опрыскивайте растения слабым раствором перекиси (25 г 3%-го раствора на 1 л воды). Это обезопасит их от любых вредителей и грибка, укрепит иммунитет.
Перед мытьем головы нанесите слабый раствор Н2О2 на волосы. Это придаст волосам пышность и блеск.
Добавьте в холодную воду немного перекиси и подержите в ней фрукты. Действенное средство против пестицидов и других химических веществ!
При помощи перекиси очень легко очищается даже самая грязная столешница.
Чтобы отбелить зубы и обеззаразить ротовую полость, прополощите рот перекисью водорода.
Если хотите, что бы холодильник сверкал, помойте его с перекисью.
Легко очистить ванную от грибка, перекись не подведет. Перед уборкой нанесите её на проблемные места и оставьте на 5 минут.
Если у вас жирная кожа, используйте перекись для протирания лица. Прекрасное профилактическое средство против прыщей.
Перекись - прекрасное средство для лечения грибка, подержите ноги в её растворе.
Капелька перекиси поможет предотвратить возникновение слизи и грибка в аквариумной воде. Рыбам и черепахам она не навредит!
Вот как необычно можно использовать перекись водорода. Применения этого простого вещества в разных бытовых делах стало для меня открытием… Именно поэтому я назвала свою работу «Прекрасная перекись».
Огромным преимуществом перекиси водорода считаю то, что она безвредна и может применяться даже для новорождённых (в разбавлении, конечно). Другое преимущество – доступность в аптеке и невысокая цена.
Возьмите бутылочку перекиси и посмотрите на нее. Вы держите в руках волшебное вещество, настоящее сокровище!
А раз так, осталось предупредить о хранении. Перекись водорода нужно хранить в прохладном месте, избегая воздействия света. И обязательно подальше от детей! Не надо забывать, что это вещество не такое уж и безобидное и неопасное, как и любой продукт химии, как и любой лекарственный препарат. Тут уместно выражение известнейшего средневекового врача Парацельса, который утверждал, что лекарство и яд отличаются только дозой.
Надеюсь, что после моих исследований многие узнают об огромных возможностях, которые представляет нам такая знакомая и «прекрасная» перекись!
ИСТОЧНИКИ ИНФОРМАЦИИ
Ахметов Н. С. Общая и неорганическая химия. М.: Высшая школа, 2001
Габриелян О.С., Лысова Г.Г. Химия 11. М.: Дрофа. 2005
Глинка Н.Л. Общая химия. М., Интеграл-Пресс, 2009.
Грандберг И.И. Органическая химия-М: Высшая школа, 2000
Ершов Ю.А., Попков В.А. и др. Общая химия. Биофизическая химия (учеб. для мед. спец. вузов). М.: Высш. шк., 1995
Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия, 1994.
Максименко О.О. Химия – уч. пособие для поступающих в вузы. М.: ЭКСМО, 2003
Назарова Т.С., Грабецкий А.А., Лаврова В.Н. Химический эксперимент в школе. М., «Просвещение». 1987
Третьяков Ю.Д. Химия, Справочные материалы-М: Просвещение,1984
Хомченко Г.П. Химия для поступающих в ВУЗы,- Высшая школа,2005
http://www.kristallikov.net/ Занимательные опыты
http://www.popmech.ru/diy/ Популярная механика. Извержение пустоты
implescience.ru/video/ Простая наука. Увлекательные опыты для детей
http://znanija.com/ Знания. Вещества из домашней аптечки.
http://festival.1september.ru/ Урок химии по теме "Химия в аптечке
https://ru.wikipedia.org/wiki/ Пероксид (перекись) водорода
http://vredna.ru/ Вредна ли перекись водорода?
http://sevnews.net/ Лечение перекисью водорода
http://schoolchemistry.by.ru/ Статьи о пероксиде водорода
18

 Получите свидетельство
Получите свидетельство Вход
Вход







































 2 + ( NH 4 ) 2 SO 4 2H 2 O 2 → 2H 2 O + O 2](https://fsd.videouroki.net/html/2018/08/17/v_5b76edb62894c/img_v99718898_0_14.jpg)













 "Прекрасная перекись" (6.28 MB)
"Прекрасная перекись" (6.28 MB)
 0
0 1672
1672 117
117 Нравится
0
Нравится
0


