
«В царстве Рыжего дьявола».

Цель урока : создать условия для осознания и осмысления блока новой информации посредством системы вопросов и нестандартных заданий для самостоятельной работы, развивающих познавательную активность учащихся.
Образовательные цели: ознакомить учащихся с видами коррозии, её механизмом, со способами защиты металлов от коррозии; объяснить процессы окисления и восстановления, протекающие на поверхности металла в результате коррозии .
Развивающие цели: развивать мышление учащихся, умения анализировать, сравнивать, обобщать, наблюдать, запоминать, работать в нужном темпе, осуществлять самоконтроль.
Воспитательная цель: воспитывать личные качества, обеспечивающие успешность исполнительской деятельности (дисциплинированность. ответственность), творческой деятельности (активность, увлечённость, наблюдательность, сообразительность, способность к самооценке), готовность к жизни в семье и обществе (приветливость, уважительность, требовательность ).

Металлы в жизни человека

«Рыжая крыса грызёт металлический лом».
( Вадим Шефнер).
Девиз: « Знать- значит
победить!»
( А.Н.Несмеянов.)

По подсчётам экономистов, наносимый коррозией ущерб во много раз превышает потери даже от такого стихийного бедствия , как пожар?! Это и неудивительно: ведь огонь буйствует сравнительно редко, а коррозия действует постоянно, ни на один час, ни на одно мгновение не прекращая свою подрывную работу. Она уничтожает примерно 15% всех производимых в мире металлов (20 млн. тонн), досрочно выводит из строя оборудование, детали и целые сооружения. Существенны и косвенные убытки: утечка нефти или газа из съеденного коррозией трубопровода.

Графический диктант
вариант 1. вариант 2.
медь калий
- Это активный щелочной металл.
- Этот металл занимает второе место по электропроводности.
- Это очень мягкий металл.
- Этот металл входит в состав бронзы.
- На внешнем энергетическом уровне атомов этого металла два электрона.
- Металл не взаимодействует с водой.
- Металл можно использовать для выделения цинка из раствора его соли.
- В реакциях с галогенами выступает в роли окислителя.
- Этот металл можно получить электролизом расплава его соли.
- При хранении на открытом воздухе металл окисляется.
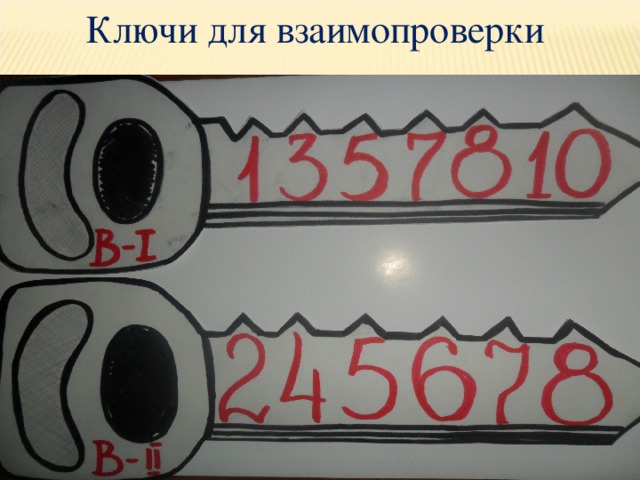
Ключи для взаимопроверки

Коррозия- это разрушение металлов под воздействием внешней среды, это окислительно - восстановительный процесс, при котором атомы металла превращаются в ионы .
Слово «коррозия» происходит от латинского с orrodere - разъедать.
По характеру взаимодействия металла и среды различают два основных вида коррозии: химическую и электрохимическую.
Химическая коррозия - разрушение металла в результате окисления его в окружающей среде без возникновения электрического тока в системе.
Например, окисление железа происходит под действием кислорода воздуха или кислорода, растворенного в воде.

Этап 1: железо окисляется до гидроксида железа ( ΙΙ ):
2Fe ⁰+O⁰ 2 +2H 2 O=2Fe⁺²(O¯²H) 2
Fe⁰−2e¯→Fe⁺² 2 восстановитель
О⁰ 2 +4е¯→2О¯² 1 окислитель
Этап 2: окисление гидроксида железа ( ΙΙ ) до метагидроксида железа ( ΙΙΙ ):
4Fe⁺²(OH) 2 +O⁰ 2 =4Fe⁺³O(OH)+2H 2 O¯²
Fe⁺²−e→Fe⁺³ 4 восстановитель
O⁰ 2 +4e→ 2O¯² 1 окислитель
Этап 3: взаимодействие гидроксида железа ( ΙΙ ) и метагидроксида железа ( ΙΙΙ ):
ΙΙ ΙΙΙ ΙΙ ΙΙΙ
Fe(OH) 2 +2FeO(OH)=(FeFe 2 )O 4 +2H 2 O
или Fe 3 O 4
ржавчина

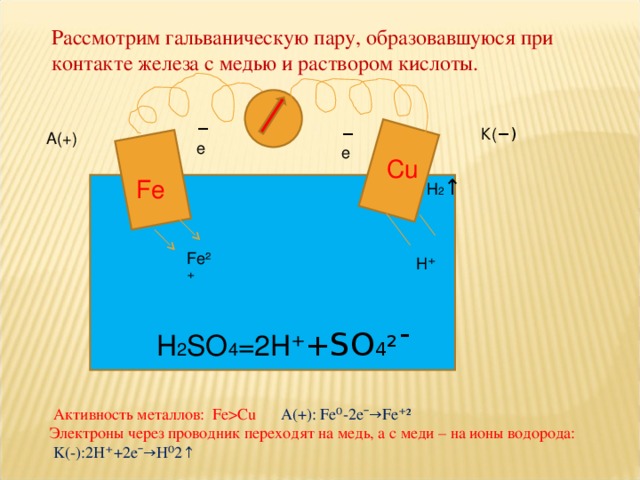
Электрохимическая коррозия- разрушение металла в результате возникновения гальванической пары и появления внутри системы электрического тока.
Электрохимическая коррозия возникает при контакте двух металлов в среде электролита ( в гальванической паре), электродами при этом являются сами металлы. При возникновении гальванической пары появляется электрический ток тем большей силы, чем дальше стоят друг от друга металлы в электрохимическом ряду напряжений. При этом поток электронов идёт от более активного металла к менее активному; более активный металл в этом случае разрушается (корродирует).
 Cu A(+) : Fe⁰-2e¯→Fe⁺² Электроны через проводник переходят на медь, а с меди – на ионы водорода: K(-) : 2H⁺+2e¯→H⁰2↑ " width="640"
Cu A(+) : Fe⁰-2e¯→Fe⁺² Электроны через проводник переходят на медь, а с меди – на ионы водорода: K(-) : 2H⁺+2e¯→H⁰2↑ " width="640"
Рассмотрим гальваническую пару, образовавшуюся при контакте железа с медью и раствором кислоты.
−
е
−
К( −)
е
А(+)
Cu
Н 2 ↑
Fe
Fe² ⁺
H ⁺
H 2 SO 4 =2H ⁺+ SO 4 ²¯
Активность металлов: FeCu A(+) : Fe⁰-2e¯→Fe⁺²
Электроны через проводник переходят на медь, а с меди – на ионы водорода:
K(-) : 2H⁺+2e¯→H⁰2↑

Опыт по коррозии металлов .
В 4 стакана опущены железные гвозди. В первом стакане гвоздь в воде, во втором – в растворе поваренной соли, в третьем в раствор поваренной соли опущен гвоздь в контакте с медной пластиной, в четвёртом- гвоздь в контакте с цинковой пластиной.

Вопросы:
? Определите тип коррозии в каждом стакане.
? Где железный гвоздь прокорродировал сильнее, где в меньшей степени . Почему?
? Объясните , что усиливает коррозию, а что её замедляет?
? Подготовьте обобщённый вывод по результатам опыта.

«Просто знать - ещё не всё, знания нужно уметь
использовать».
( Гёте).
- Способы защиты металлов от коррозии .
- Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла.
- Использование нержавеющих сталей, содержащих специальные добавки.
- Введение в рабочую среду ингибиторов, уменьшающих агрессивность среды.
- Создание контакта с более активным металлом- протектором .

Подумайте и объясните:
? Почему рядом со стальной коронкой не рекомендуют ставить золотую?
? Трюмы норвежского грузового судна «Анатина», направлявшегося к берегам Японии, были заполнены медным концентратом. Корпус судна был сделан из стали. Внезапно судно дало течь. Что произошло?
? Знаменитая Кутубская колонна в Индии близ Дели вот уже более полутора тысяч лет не разрушается, несмотря на жаркий и влажный климат. Сделана она из железа, в котором почти нет примесей. Предположите. Почему колонна не подвергается коррозии.
? Объясните химические процессы, упоминаемые А.Ахматовой:
На рукомойнике моём позеленела медь,
Но так играет луч на нём, что весело глядет ь.

- Сегодня на уроке меня заинтересовало
- Самым сложным для меня сегодня было
- Сегодня я задумался
- На будущее мне нужно иметь в виду
- Что осталось непонятным на уроке

§ 10 ,Упр.1-5.
Домашнее задание:


 Получите свидетельство
Получите свидетельство Вход
Вход













 Cu A(+) : Fe⁰-2e¯→Fe⁺² Электроны через проводник переходят на медь, а с меди – на ионы водорода: K(-) : 2H⁺+2e¯→H⁰2↑ " width="640"
Cu A(+) : Fe⁰-2e¯→Fe⁺² Электроны через проводник переходят на медь, а с меди – на ионы водорода: K(-) : 2H⁺+2e¯→H⁰2↑ " width="640"















 Презентация по химии "Коррозия металлов" (3.55 MB)
Презентация по химии "Коррозия металлов" (3.55 MB)
 0
0 1399
1399 72
72 Нравится
0
Нравится
0


