
Номенклатура и классификация неорганических соединений
ОКСИДЫ, КИСЛОТЫ,
СОЛИ
презентация подготовлена
учителем химии ГБОУ СОШ № 2047
КОВАЛЕВОЙ Н.Ю.

Оксиды
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород
Примеры: SO 2 – оксид серы (IV)
SO 3 - оксид серы (VI)
P 2 O 5 – оксид фосфора (V)
Fe 2 O 3 - оксид железа (III)
CaO– оксид кальция
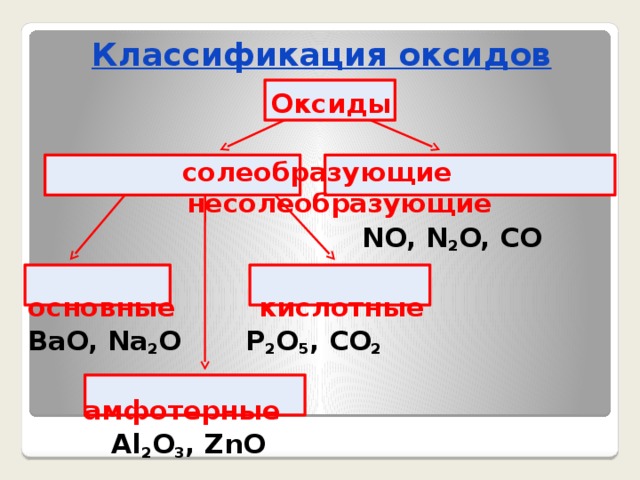
Классификация оксидов
Оксиды
солеобразующие несолеобразующие
NO, N 2 O, CO
основные кислотные
BaO, Na 2 O P 2 O 5 , CO 2
амфотерные
Al 2 O 3 , ZnO

Определения оксидов
Основные оксиды:
- состоят из атомов металлов и кислорода;
- им соответствуют основания:
Li 2 O LiOH
CaO Ca(OH) 2
Cu 2 O CuOH
CuO Cu(OH) 2
FeO Fe(OH) 2
Fe 2 O 3 Fe(OH) 3

Определения оксидов
Кислотные оксиды:
- состоят из атомов неметаллов и кислорода;
- им соответствуют кислородсодержащие кислоты:
CO 2 H 2 CO 3
SO 2 H 2 SO 3
SO 3 H 2 SO 4
P 2 O 5 H 3 PO 4
Mn 2 O 7 HMnO 4
CrO 3 H 2 CrO 4
Cl 2 O 7 HClO 4
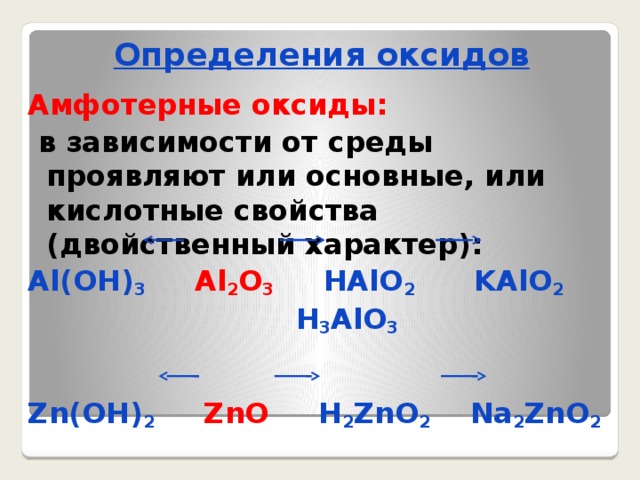
Определения оксидов
Амфотерные оксиды:
в зависимости от среды проявляют или основные, или кислотные свойства (двойственный характер):
Al(OH) 3 Al 2 O 3 HAlO 2 KAlO 2
H 3 AlO 3
Zn(OH) 2 ZnO H 2 ZnO 2 Na 2 ZnO 2

Определения оксидов
Несолеобразующие оксиды:
не образуют ни кислот, ни оснований:
NO, N 2 O, CO
Некоторые элементы с переменной валентностью могут образовывать основные, кислотные и амфотерные оксиды:
CrO – оксид хрома (II) - основный
Cr 2 O 3 – оксид хрома (III) - амфотерный
CrO 3 – оксид хрома (VI) - кислотный

Кислоты
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка
Примеры: HCl – соляная кислота
H 2 S – сероводородная кислота
HNO 3 – азотная кислота
H 2 SO 4 - серная кислота

Классификация кислот
I.По кислотному остатку
Кислородсодержащие Бескислородные
H 2 SO 4, H 2 CO 3 HBr, H 2 S, HCl
II. По количеству атомов водорода
Одноосновные Двухосновные Трехосновные
HNO 3 H 2 SiO 3 H 3 PO 4

Таблица кислот
Формула
Название кислот
HF
HCl
Кислотн. остаток
фтороводородная (плавиковая)
HBr
хлороводородная (соляная)
-F (I)
Название кислотного остатка
фтор ид
-Cl (I)
бромоводородная
HI
H 2 S
хлор ид
-Br (I)
иодоводородная
сероводородная
бром ид
-I (I)
H 2 SO 3
иод ид
-S (II)
сернистая
H 2 SO 4
сульф ид
-SO 3 (II)
серная
сульф ит
-SO 4 (II)
сульф ат
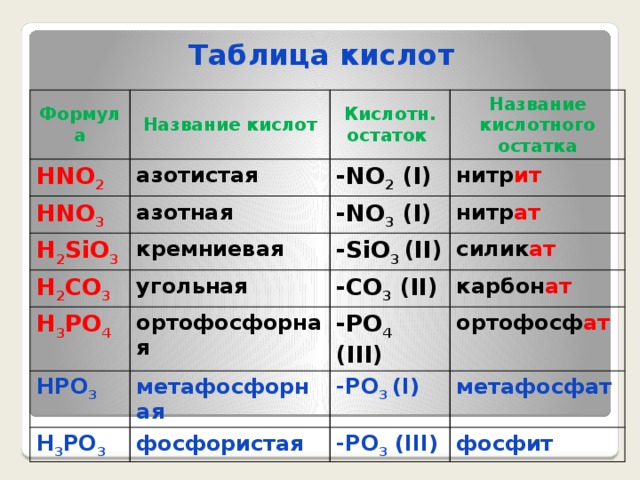
Таблица кислот
Формула
Название кислот
HNO 2
HNO 3
Кислотн. остаток
азотистая
H 2 SiO 3
азотная
-NO 2 (I)
Название кислотного остатка
нитр ит
-NO 3 (I)
кремниевая
H 2 CO 3
H 3 PO 4
нитр ат
-SiO 3 (II)
угольная
ортофосфорная
силик ат
-CO 3 (II)
HPO 3
карбон ат
-PO 4 (III)
метафосфорная
H 3 PO 3
ортофосф ат
-PO 3 (I)
фосфористая
метафосфат
-PO 3 (III)
фосфит
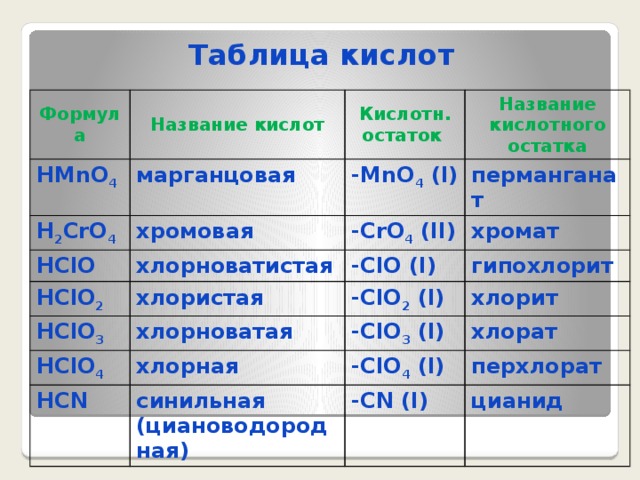
Таблица кислот
Формула
Название кислот
HMnO 4
H 2 CrO 4
Кислотн. остаток
марганцовая
HClO
хромовая
-MnO 4 (I)
Название кислотного остатка
перманганат
-CrO 4 (II)
хлорноватистая
HClO 2
HClO 3
хромат
-ClO (I)
хлористая
хлорноватая
гипохлорит
-ClO 2 (I)
HClO 4
хлорит
-ClO 3 (I)
хлорная
HCN
хлорат
-ClO 4 (I)
синильная (циановодородная)
перхлорат
-CN (I)
цианид

Соли
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками
соль соляной кислоты HCl
соль серной кислоты H 2 SO 4
- Mg 3 (PO 4 ) 2 – фосфат магния
соль фосфорной кислоты H 3 PO 4

Классификация солей
Средние: Na 3 PO 4, K 2 SO 4, MgCl 2
Кислые: NaH 2 PO 4, Na 2 HPO 4, KHSO 4
Основные: Mg(OH)Cl
Двойные: K 2 NaPO 4
Смешанные: CaOCl 2
Комплексные: K 3 Fe(CN) 6

Дайте названия веществам. К какому классу неорг. соедин. они относятся?
Оксид кальция – осн. оксид
Гидроксид кальция – основание
Нитрат кальция – соль
Азотная кислота – кислота
Оксид азота (V) – кисл. оксид
Сульфат алюминия - соль
CaO
Ca(OH) 2
Ca(NO 3 ) 2
HNO 3
N 2 O 5
Al 2 (SO 4 ) 3

 Получите свидетельство
Получите свидетельство Вход
Вход



























 Номенклатура и классификация неорганических соединений (0.11 MB)
Номенклатура и классификация неорганических соединений (0.11 MB)
 0
0 2401
2401 89
89 Нравится
0
Нравится
0


