Министерство образования, науки и молодежной политики Краснодарского края Государственное бюджетное профессиональное образовательное учреждение «Армавирский индустриально-строительный техникум»
Методические рекомендации
по выполнению практических и лабораторных работ
по дисциплине «Химия»
Химический практикум

г. Армавир, 2016 г.
Методические рекомендации по выполнению практических и лабораторных работ по дисциплине «Химия». Химический практикум.
Составитель: Смирнова Галина Анатольевна
Методические рекомендации предназначены для проведения практических и лабораторных работ на занятиях по органической и неорганической химии.
Выполнение данных работ предусматривает решение небольших практических задач - получить то или иное вещество, продемонстрировать характерные реакции вещества, идентифицировать выданные вещества, сравнить свойства органических и неорганических веществ.
Для выполнения таких задач необходимо детально продумать план их решения и выполнить практически. После выполнения практического задания обучающиеся отвечают на теоретические вопросы.
Перед выполнением этих работ необходимо использовать инструкции, выданные преподавателем и повторить технику проведения этих опытов по учебнику органической и неорганической химии.
Содержание Введение……………………………………………………………….…4 Практическая работа №1: Приготовление раствора заданной концентрации……………….………………………………………...….6 Практическая работа № 2: Получение, собирание и распознавание газов…………………….…………………………………………………8 Практическая работа № 3: Решение экспериментальных задач………………………………………………….…………………..10 Практическая работа № 4 :Решение экспериментальных задач на идентификацию органических соединений…………………………11 Практическая работа № 5 :Распознавание пластмасс и волокон.…...12 Лабораторная работа № 1: Взаимодействие металлов с кислотами, кислот с оксидами металлов, с основаниями, с солями………..…...14 Лабораторная работа №2: Взаимодействие солей с металлами, щелочей с солями. Взаимодействие солей друг с другом. Гидролиз солей различного типа…………………………………………..……………15 Лабораторная работа № 3: Реакция замещения меди железом в растворе медного купороса,с образованием осадка, газа или воды …………..17 Лабораторная работа № 4: Зависимость скорости взаимодействия соляной кислоты с металлами от их природы………………………..19 Лабораторная работа №5: Растворение глицерина в воде и взаимодействие с гидроксидом меди (II), глюкозы и сахарозы с гидроксидом меди (II)…………………………………………………..21 Лабораторная работа №6: Доказательство непредельного характера жидкого жира. Качественная реакция на крахмал…………………...24 Лабораторная работа №7: Растворение белков в воде. Обнаружение белков в молоке и мясном бульоне………………………………….....25 Лабораторная работа №8: Денатурация раствора белка куриного яйца спиртом, растворами солей тяжелых металлов и при нагревании…..26 Правила безопасности в химической лаборатории ………………….27 Список литературы……………………………………………………...29
Введение
В данных методических указаниях описаны методики выполнения лабораторных и практических работ по общей и органической химии, дано краткое теоретическое введение к каждой теме, которое при самостоятельной подготовке поможет обучающимся выполнить эти работы. В приложении к указаниям приведены справочные таблицы, правила техники безопасности и мероприятия по оказанию первой помощи. Методические указания выполнены в соответствии с рабочей программой составленной на основе федерального государственного образовательного стандарта среднего по химии. Пособие поможет обучающимся совершенствовать практические умения и закрепить теоретические знания по дисциплине «Химия». Описаны методики выполнения лабораторных и практических работ, приведены контрольные вопросы, фиксирующие внимание студентов на наиболее важные этапы изучаемого материала. Контрольные вопросы составлены на основе личностно-ориентированного подхода в обучении.
В процессе выполнения лабораторных работ, обучающиеся должны наблюдать за ходом эксперимента, отмечать все его особенности (изменение цвета, тепловые эффекты, выпадение осадка, образование газообразных веществ). Результаты наблюдений записывают в тетради для лабораторных работ, поддерживаясь определенной последовательности:
- дата выполнения, название лабораторной работы;
- цель работы;
- краткие теоретические сведения, касающиеся данной работы;
- зарисовка схемы установки (выполняется карандашом);
- результаты опытов должны быть внесены в таблицу;
- выводы.
В приложении к пособию приведены справочные таблицы, правила техники безопасности и мероприятия по оказанию первой помощи.
Рекомендации по составлению письменного отчета о выполненной практической работе.
Для оформления отчета о работе удобно использовать табличную форму.
| Ход опыта | Наблюдение | Уравнение реакции | Вывод |
|
|
|
|
|
«Ход опыта» записывается кратко, вместо словесного описания последовательности действий используется рисунок. Обязательно указываются условия осуществления химических реакций.
В графе «Наблюдения» рисунок или схема поясняются следующими обозначениями:
-образование осадка: ↓ Указывается цвет осадка и его характер (мучнистый, творожистый, студенистый); - выделение газообразного вещества: ↑ Указывается цвет газа, запах, плотность.
В графе «Уравнения реакций» учащиеся могут выражать только сущность реакций ионного обмена, т.е. записывать только сокращенные ионные уравнения реакций. Для окислительно-восстановительных реакций записываются молекулярное уравнение реакции, выражается ее сущность методом электронного баланса или электронно-ионным методом. Указываются названия процессов и функции веществ.
Особого внимания требует заполнение графы «Вывод». Вывод должен соответствовать условию задачи, быть полным и обоснованным.
Практическая работа № 1
Тема: Приготовление раствора заданной концентрации.
Цель: Овладение навыками приготовления растворов определенной концентрации, с соблюдением правил техники безопасности.
Задача: Закрепить знания по теме « Вода. Растворы. Электролитическая диссоциация».
Реактивы и оборудование: Хлорид натрия (NaCl), 60% концентрированная серная кислота, дистиллированная вода, весы, бюксы, мерная колба (100мл).
Теоретические основы
Раствор – гомогенная система, состоящая из растворенного вещества и растворителя.
При решении задач пользуются формулами:
W Р.В. = m Р.В. / m Р-РА.
mр-ра = m Р.В. + m Н2О
m Р-РА – масса раствора, г.
m Р.В. – масса растворенного вещества, г.
m Н2О – масса воды, г.
WР.В. - массовая доля растворенного вещества.
10% раствор вещества содержит 10г растворенного вещества и 90г воды в 100г раствора.
Например: Определите массовую долю растворенного вещества, если 10 г его содержится в 100 г раствора. Какая масса воды содержится в растворе.
Дано: mР.В. = 10 г; mр-ра = 100 г
Найти: W Р.В.; m Н2О
Решение:
1. W Р.В. =�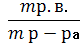 �; W Р.В. = �
�; W Р.В. = �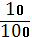 � = 0,1
� = 0,1
2. mн2о = mр-ра – mр.в.; mн2о = 100 – 10 = 90 г
Ответ: 0,1; 90 г
Выполнение работы
1.Приготовление 2% раствора соли.
Взвесьте в бюксе 2г хлорида натрия и пересыпьте через воронку в колбу на 100мл. Затем в колбу добавьте воды до метки. Полученный раствор имеет 2% концентрацию NaCl в 100г раствора или 0,02 массовую долю NaCl в 100г раствора.
2. Приготовление 100 мл 10% раствора серной кислоты.
Раствор готовят из 60% концентрированного раствора серной кислоты плотностью 1,5 г/мл. Для этого мензуркой отмеряют 11 мл 60% концентрированной серной кислоты и мерным цилиндром 100-11=99 мл воды. Воду выливают в колбу, а затем добавляют из мензурки кислоту. Полученный раствор содержит 0,1 массовую долю H2SO4.
Контрольные вопросы
1. Что такое растворы?
2.Из чего складывается масса раствора?
3. Как определяется массовая доля растворенного вещества в растворе?
4. Как приготовить10% раствор щелочи NaOH? Какая масса NaOH и воды содержится в таком растворе?
5. Решите задачу
1 уровень
1вариант:
Определите массовую долю растворенного вещества, если 20 г его содержится в 150 г раствора?
2 вариант:
Чему равна масса раствора, если 10г вещества растворили в100г воды?
2 уровень
1 вариант:
Определите массовую долю (%) KOH в растворе, если 40г KOH растворили в воде массой 160г.
2 вариант:
Чему равна масса растворенного вещества, если в200 г раствора массовая доля вещества составляет 0,2.
3 уровень
1 вариант:
К 200 граммам раствора, содержащего 0.3 массовые доли растворенного NaCl, добавили 100 граммов воды. Вычислите массовую долю NaCl в полученном растворе.
2 вариант:
Определите массу воды, которая содержится в растворе массой 300 г с массовой долей растворенного вещества равной 0,5?
Сформулируйте вывод по работе.
Практическая работа № 2
Тема: Получение, собирание и распознавание газов.
Цель: Развитие навыков получения, собирания и распознавания водорода, аммиака, углекислого газа.
Задача: Закрепление знаний по теме «Металлы и неметаллы».
Реактивы и оборудование: Штативы, пробирки с газоотводными трубками, держатели, спички, сосуд с водой. Растворы HCl, NaOH, Ca(OH)2; CaCO3 (мрамор), NH4Cl, универсальная лакмусовая бумажка.
Теоретические основы
Водород – бесцветный газ, без запаха. В 14,4 раза легче воздуха, обладает наибольшей диффузионной способностью, а отсюда и высокой теплопроводностью. Плохо растворяется в воде, но может растворяться в некоторых металлах. В лаборатории водород получают: взаимодействием цинка с разбавленной хлороводородной кислотой: Zn + 2HCl = ZnCl2 + H2
растворением алюминия в щелочах: 2Al +2NaOH + H2O = 2NaAlO2 + 3H2
Кислород – бесцветный газ, не имеет вкуса и запаха, немного тяжелее воздуха, малорастворим в воде.
В лаборатории кислород получают: 2KCl = 2KCl + 3O2 2KMnO4 = K2MnO4 + MnO2 + O2
Оксид углерода (IV) – бесцветный, негорючий газ, тяжелее воздуха, в воде растворяется незначительно. В твердом состоянии легко получается путем испарения жидкой СО2 , находящейся под давлением. Твердая СО2 называется сухим людом.
Оксид углерода (IV) (углекислый газ) можно получить: При горении угля в избытке кислорода: С + О2 = СО2
При разложении карбонатов и гидрокарбонатов: СаСО3 = СО2 + СаО
Действием на карбонат хлороводородной кислоты: CaCO3 + 2HCl = CaCl2 + H2O + CO2
При действии метана с водяным паром и кислородом: 2СН4 + 2Н2О + О2 = 2СО2 + 4Н2
Аммиак – бесцветный газ, легче воздуха, с резким запахом, хорошо растворим в воде с образованием щелочи: NH3 + H2O = NH4OH
Аммиак в лаборатории получают:
Действием на хлорид аммония щелочью при нагревании: NH4Cl + NaOH = NaCl + NH3↑ + H2O
При нагревании гидроксида аммония: NH4OH → NH3↑ + H2O
Выполнение работы
1. Получение, собирание и распознавание водорода.
В пробирку с притертой крышкой и газоотводной трубкой поместите несколько гранул Zn и прилейте 4 мл раствора HCl. Соберите выделяющийся газ водород методом вытеснения из воды, для этого поместите пробирку в сосуд с водой и введите в нее газоотводную трубку. Для распознавания водорода поднесите к отверстию газоотводной трубки горящую лучину.
Произойдет хлопок. Запишите наблюдения и химические реакции.
2. Получение, собирание и распознавание углекислого газа.
В пробирку с притертой крышкой и газоотводной трубкой поместите несколько кусочков мрамора (CaCO3) и прилейте 4мл раствора HCl. Соберите выделяющийся газ методом вытеснения воздуха, для этого газоотводную трубку поместите в другую пробирку. Газ соберется на дне пробирки. Для распознавания CO2 в пробирку с собранным газом внесите горящую лучинку, она должна потухнуть. А так же пропустите выделяющийся газ через раствор Ca(OH)2 ,раствор станет мутным. Запишите наблюдения и химические реакции.
3. Получение, собирание и распознавание аммиака.
В пробирку с притертой крышкой и газоотводной трубкой поместите сухую соль хлорида аммония (NH4Cl) и прилейте 2мл раствора NaOH. Соберите выделяющийся газ методом вытеснения воздуха, для этого газоотводную трубку поместите в другую пробирку с перевернутым дном. Для распознавания NH3 поместите пробирку с собранным газом в сосуд с водой. Вода наполнит пробирку, в полученный раствор внесите лакмусовую бумажку. Лакмусовая бумажка станет синей, так как образовался раствор аммиака (NH4OH)и появится резкий запах. Запишите наблюдения и химические реакции.
Сделайте вывод по работе.
Контрольные вопросы
1. Каким способом собирают газ водород? Почему?
2. Каким способом собирают углекислый газ CO2? Почему?
3. Каким способом собирают газ аммиак? Почему?
4. Какие из полученных газов хорошо растворяются в воде, и какие вещества при этом образуются?
5. Зарисуйте схемы приборов для получения газов.
6. Решите задачу
1 уровень
Какой объем водорода при н.у. выделится при взаимодействии 64 г цинка с серной кислотой?
2 уровень
При взаимодействии с 53,5г хлорида аммония с гидроксидом натрия выделился газ с резким запахом и вода. Определите объем газа при н.у. и объем воды?
3 уровень
При взаимодействии 110г известняка, содержащего 0,9 массовых долей карбоната кальция с соляной кислотой выделился газ. Определите объем газа при н.у.?
Практическая работа № 3 Тема: Решение экспериментальных задач
Цель: Опытным путем распознать выданные неизвестные вещества.
Оборудование: набор химических реактивов и соединений, химическая посуда и оборудование.
Задание №1. Дана смесь, состоящая из хлорида калия и сульфата железа ( III ). Проделайте опыты, при помощи которых можно определить CI - и Fe 3+. Напишите уравнения соответствующих реакций в молекулярном и ионном виде.
Задание №2. Выданы вещества: кристаллогидрат сульфата меди (II), карбонат магния, гидроксид натрия, железо, соляная кислота, хлорид железа(III). Пользуясь этими веществами, получите: гидроксид железа (III);гидроксид магния; медь.
Опытным путём определите, какие вещества находятся в каждой из пробирок.
Составить уравнения проделанных реакций в молекулярном и ионном виде.
Задание№3. В трёх пробирках даны кристаллические вещества без надписей: сульфат аммония; нитрат меди (II);хлорид железа (III). Опытным путём определите, какие вещества находятся в каждой из пробирок.
Составить уравнения проделанных реакций в молекулярном и ионном виде.
Задание №4. В пробирках даны смеси твердых веществ:
сульфат натрия, сульфид натрия, сульфит натрия;
карбонат калия, сульфат калия, хлорид аммония;
сульфат аммония, сульфат алюминия, нитрат калия.
Опытным путём определите, какие вещества находятся в каждой из пробирок.
Составить уравнения проделанных реакций в молекулярном и ионном виде. Практическая работа №4
Тема: Решение экспериментальных задач по органической химии
Цель: с помощью характерных реакций распознать предложенные соединения.
Оборудование: набор химических веществ, реактивы, химическая посуда.
Опыт №1. Определите, в какой из пробирок находятся водные растворы:
1.Этанола 3. Глюкозы
2.Уксусной кислоты 4.Глицерина
Опыт №2. Определите, в какой из пробирок находятся водные растворы:
1.Фенола 3. Формальдегида
2.Глицерина 4. Глюкозы
Опыт №3. Определите, в какой из пробирок находятся:
1.Глицерин 3. Машинное масло, полученное из нефти
2.Растительное масло 4. Сахарный сироп
Опыт №4. Определите, с помощью одного и того же реактива, в какой из пробирок находятся водные растворы:
1.Фенолята натрия 3. Ацетата натрия
2.Этилацетата натрия 4. Карбоната натрия
Опыт №5. Определите, с помощью одного и того же реактива, в какой из пробирок находятся водные растворы:
1.Мыла
2.Белка
3.Соды.
Опыт №6. Используя одну и ту же реакцию, но разные условия её протекания, распознайте растворы веществ:
1.Глицерина
2.Формалина
3.Белка
Практическая работа № 5
Тема: Распознавание пластмасс и волокон.
Цель: Развитие умений решения экспериментальных задач на идентификацию органических соединений. Ознакомление на основе коллекционного материала с образцами пластмасс и волокон.
Задача: Закрепить знания по теме «Азотсодержащие органические соединения. Полимеры».
Обеспечивающие средства: Коллекции « Пластмассы», «Волокна».
Теоретические основы
Пластмассами называют материалы, изготавливаемые на основе полимеров, способные приобретать при нагревании заданную форму и сохранять ее после охлаждения.
Пластмассы бывают:
Термопластичные полимеры при нагревании размягчаются и в этом состоянии легко изменяют форму. При охлаждении они снова затвердевают и сохраняют приданную форму. При следующем нагревании они снова размягчаются, придают новую форму.
Термореактивные полимеры при нагревании сначала становятся пластичными, но затем утрачивают пластичность, становятся неплавкими и нерастворимыми, так как в них происходит химическое взаимодействие между линейными макромолекулами, образует пространственная структура полимера.
| Пластмассы |
| Термопластичные: полиэтилен; поливинилхлорид; полистирол; полиметилметакрилат | Термореактивные: фенолформальдегидные; мочевиноформальдегидные; целлулоид |
Изготовление волокон и тканей – вторая обширная область народнохозяйственного применения синтетических высокомолекулярных веществ.
Волокна делятся на природные и химические.
Выполнение работы
1.Решение экспериментальных задач на идентификацию органических соединений.
1 уровень
Выберите соединение, с помощью которого можно распознать глицерин.
Реактивы: Cu (OH) 2; NaOH; HCl
Выберите соединение, с помощью которого можно распознать уксусную кислоту.
Реактивы: синий лакмус; запах; NaOH
Выберите соединение, с помощью которого можно распознать уксусный альдегид.
Реактивы: Ag2O + NH4OH; H2SO4; NaOH
2 уровень
Выберите соединение, с помощью которого можно распознать глицерин и уксусную кислоту.
Реактивы: гидроксид меди(II); запах; синий лакмус; металлический натрий
Выберите соединение, с помощью которого можно распознать этиловый спирт и уксусный альдегид.
Реактивы: запах; металлический натрий, аммиачный раствор оксида серебра.
Выберите соединение, с помощью которого можно распознать крахмал и глюкозу.
Реактивы: гидроксид меди(II); раствор йода; аммиачный раствор оксида серебра; соляная кислота.
3 уровень
1 вариант
Выберите реактивы, с помощью которых можно распознать в веществах наличие глицерина, уксусной кислоты, крахмала, формалина и дайте объяснение.
Реактивы: Гидроксид натрия, гидроксид меди (II),карбонат натрия, раствор иода, синий лакмус, аммиачный раствор серебра.
2 вариант
Выберите реактивы, с помощью которых можно распознать в веществах наличие белка, глюкозы, фенола, глицерина и дайте объяснение.
Реактивы: Гидроксид натрия, гидроксид меди (II), аммиачный раствор серебра, сульфат меди (II), раствор брома, азотная кислота.
2. Ознакомление с коллекциями образцов пластмасс и волокон.
Рассмотрите коллекции «Пластмассы» и «Волокна» Запишите внешние признаки пластмасс и волокон в таблицу.
Таблица
Физические свойства пластмасс и волокон.
| Название | Цвет | Твердость | Эластичность | Хрупкость |
| Пластмассы |
|
|
|
|
| 1.Полиэтилен |
|
|
|
|
| Волокна |
|
|
|
|
| 1.Шерсть |
|
|
|
|
Контрольные вопросы
1. Какие вещества называются полимерами?
2. Назовите известные вам полимерные соединения и их область применения.
3. Как классифицируются химические волокна?
4. Назовите известные вам волокна и их область применения.
Сформулируйте вывод по работе.
Лабораторная работа № 1
Тема: Взаимодействие кислот с металлами, с оксидами металлов, с основаниями и солями.
Цель: Овладение умениями проведения химических опытов, с соблюдением правил техники безопасности, подтверждающих свойства кислот.
Задача: Закрепить знания по теме «Классификация неорганических соединений и их свойства».
Реактивы и оборудование: Растворы NaOH, H2SO4, CuSO4, Na2CO3 , индикатор метилоранж; Zn; CuO. Штатив с пробирками, горелка
Теоретические основы
Кислоты – электролиты диссоциирующие в воде на ионы водорода и ионы кислотного остатка.
H2SO4 ↔ 2H+ + SO42-
Химические свойства.
- разбавленные кислоты взаимодействуют с металлами, стоящими в ряду активности металлов до водорода, или имеющие меньший электродный потенциал, чем водород:
2HCl + Zn = ZnCl2 + H2;
- взаимодействуют с оксидами металлов:
2HCl + ZnО = ZnCl2 + H2О;
- взаимодействуют с основаниями и щелочами:
2HCl + Cu(OH)2 ↓ = CuCl2 + 2H2О
HCl + NaOH = NaCl + H2О
- взаимодействуют с солями слабых кислот
FeS + 2HCl = H2S + FeCl2
Выполнение работы
1.Взаимодействие кислоты с металлом.
В пробирку поместите гранулу цинка и прилейте раствор серной кислоты. Запишите наблюдения и химическую реакцию.
2. Взаимодействие кислоты с оксидом металла.
В пробирку поместите небольшое количество оксида меди (CuO)и прилейте раствор серной кислоты. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
3. Взаимодействие кислоты с основаниями.
3.1. В пробирку прилейте 2мл раствора серной кислоты и добавьте 2капли индикатора метилоранжа, а затем прилейте щелочь NaOH до изменения окраски раствора.
Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
3.2. В пробирку с основанием Cu(OH)2 прилейте раствор серной кислоты до растворения осадка. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
4. Взаимодействие кислоты с солями.
В пробирку прилейте 2мл раствора карбоната натрия (Na2CO3) и добавьте 2мл серной кислоты. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
Контрольные вопросы
1 уровень
1. Какие соединения называются кислотами?
2.Запишите химические формулы следующих кислот: серной, азотной, соляной, фосфорной, угольной, кремниевой.
3. Закончите реакцию: 2HCl + Ca(OH)2 = 2H2О +?
2 уровень
1. Выберите, какие вещества относятся к кислотам: NaCl; Cu (OH) 2; HNO3; Na2SO4; H2CO3.
2. Допишите предложение: Кислоты это электролиты, …
3. Напишите реакцию: Na2S + HNO3 = ? + ?
3 уровень
1. Запишите реакции диссоциации кислот: H2CO3; H2S.
2.Какие индикаторы указывают на кислую среду раствора?
3. Выполните упражнение: SO2 → SO3 → H2SO4 → Na2SO4
Сформулируйте вывод по работе.
Лабораторная работа №2
Тема: Взаимодействие солей с металлами, щелочей с солями. Взаимодействие солей друг с другом. Гидролиз солей различного типа
Цель: Овладение навыками проведения химических опытов, с соблюдением правил техники безопасности, подтверждающих свойства солей.
Задача: Закрепление знаний по теме «Классификация неорганических соединений и их свойства».
Реактивы и оборудование: Металлы Zn, Fe; растворы солей Pb(NO)3, CuSO4, Na2CO3, ZnSO4, BaCl2, KI,штатив с пробирками, индикаторы фенолфталеин и метиловый оранжевый.
Теоретические основы
Соли – электролиты диссоциирующие на ионы металла и кислотного остатка.
Ca (NO3)2 ↔ Ca2+ + 2NO-3
Соли взаимодействуют:
- с солями, усли образуется нерастворимая соль 3Na2S + 2FeCl3 = 6NaCl + Fe2S3↓
- с металлами, более активный металл вытесняет из раствора соли менее активный
CuCl2 + Zn = ZnCl2 + Cu
- со щелочами 2NaOH + ZnCl2 = 2NaCl +Zn(OH)2↓
- с более сильными кислотами, чем кислота, образующая соль FeS + 2HCl = H2S + FeCl2
Гидролиз соли это реакция взаимодействия соли с водой, в результате которой образуется ион слабого основания и меняется реакция среды раствора.
Гидролизу подвергаются соли, в состав которых входит ион слабого электролита. Если соль образована слабой кислотой и сильным основанием, то в результате гидролиза среда раствора соли станет щелочной и наоборот.
Выполнение работы
1. Взаимодействие солей с металлами.
1.1. В пробирку поместите 2мл раствора соли Pb(NO3)2 и опустите гранулу цинка. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
1.2. В пробирку поместите 2мл раствора соли CuSO4 и опустите немного железных опилок. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
2. Взаимодействие солей с солями.
2.1. В пробирку поместите 2мл раствора соли ZnSO4 и прилейте раствора соли BaCl2 до образования осадка. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
2.2. В пробирку поместите 2мл раствора соли Pb(NO3)2 и прилейте раствора соли KI до образования осадка. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
3. Гидролиз солей различного типа.
3.1.В две пробирки поместите по 2 мл раствора соли ZnSO4, в одну добавьте каплю индикатора фенолфталеина, а в другую метилового оранжевого. Укажите среду раствора соли и запишите химическую реакцию гидролиза соли.
3.2. В две пробирки поместите по 2 мл раствора соли Na2CO3, в одну добавьте каплю индикатора фенолфталеина, а в другую метилового оранжевого. Укажите среду раствора соли и запишите химическую реакцию гидролиза соли.
3.3. В две пробирки поместите по 2 мл раствора соли BaCl2, в одну добавьте каплю индикатора фенолфталеина, а в другую метилового оранжевого. Запишите наблюдения.
Контрольные вопросы
1 уровень
1.Какие соединения называются солями?
2. Запишите названия солей: ZnSO4; BaCl2.
3. Допишите предложение: Гидролизом соли называется…
2 уровень
1. Запишите формулы солей: сульфата меди (II); нитрата кальция.
2. Какие типы солей подвергаются гидролизу?
3. Закончите реакцию: Na2S + FeCl2 =? + ?
3 уровень
1. Запишите диссоциацию солей: Na2CO3 ; FeCl2.
2. Выберите соли, подвергающиеся гидролизу, укажите реакцию среды раствора: BaCl2; FeCl2; Na2S; NaNO3.
3. Запишите превращение: CuO → Cu SO4 → Cu(OH)2 → CuO
Сформулируйте вывод по работе. Лабораторная работа № 3
Тема: Реакция замещения меди железом в растворе медного купороса, с образованием осадка, газа или воды
Цель: Овладение умениями проведения различных типов химических реакций, с соблюдением правил техники безопасности.
Задача: Закрепление знаний по теме «Химические реакции».
Реактивы и оборудование: Штатив с пробирками, держатель, растворы NaOH, H2SO4,CuSO4, Na2CO3, NH4Cl, Na2SO4, ZnSO4, BaCl2, Na и вода.
Теоретические основы
Необратимые реакции протекают до конца, если выполняется три условия: выпадает осадок, образуется газообразное вещество и образуется малодиссоциирующее вещество (вода).
Образование осадка.
NaCl + AgNO3 = AgCl↓ + NaNO3 молекулярное уравнение
Na+ + Cl- + Ag+ + NO3- = AgCl↓ + Na+ + NO3— полное ионное уравнение
Ag+ + Cl- = AgCl↓ - сокращенное ионное уравнение
Образование газообразного вещества.
(NH4)2S + 2HCl = 2NH4Cl + H2S↑
2NH4+ + S2- + 2H+ + 2Cl- = 2NH4+ + 2Cl- + H2S↑
2H+ + S2- = H2S↑
Образование воды.
H2SO4 + 2KOH = K2SO4 + 2H2O
2H+ + SO42- + 2K+ + 2OH- = 2K+ + SO42- + 2H2O
2H+ + 2OH- = 2H2O
Выполнение работы.
1.Реакции, идущие с образованием газа
1.1. В пробирку поместите 2 мл раствора соли NH4Cl и прилейте такое же количество щелочи NaOH. Пробирку нагрейте до появления запаха аммиака. Запишите наблюдения и химическую реакцию.
1.2. В пробирку поместите 2 мл раствора соли Na2CO3 и прилейте 1 мл раствора серной кислоты. Запишите наблюдения и химическую реакцию.
1.3. В пробирку поместите 2 мл воды и опустите небольшой кусочек натрия. Запишите наблюдения и химическую реакцию.
2. Реакции, идущие с образованием осадка
2.1. В пробирку поместите 2 мл раствора соли CuSO4 и прилейте 4мл раствора NaOH.
Запишите наблюдения и химическую реакцию.
2.2. В пробирку поместите 2 мл раствора соли Na2SO4 и прилейте 2 мл раствора BaCl2 до образования осадка. Запишите наблюдения и химическую реакцию.
3. Реакции, идущие с образованием воды
3.1. В пробирку поместите 2мл раствора H2SO4 и 1 каплю индикатора метилового оранжевого, затем прилейте щелочи NaOH до изменения окраски раствора. Запишите наблюдения и химическую реакцию.
3.2. В пробирку поместите 2мл раствора ZnSO4 и по капелькам до образования осадка добавьте раствор щелочи NaOH. К полученному осадку прилейте H2SO4 до его растворения. Запишите наблюдения и химическую реакцию.
Контрольные вопросы
1 уровень
1. При каких условиях возможны необратимые реакции?
2. Возможна ли реакция: HCl + KOH = H2O + KCl
2 уровень
1. Запишите типы химических реакций по имеющимся классификациям.
2. Допишите реакцию: ZnCl2 + NaOH = ? +? . Почему возможна эта необратимая реакция?
3 уровень
1. Запишите типы химических реакций по имеющимся классификациям, проделанных в лабораторной работе.
2. Запишите необратимую реакцию, которая протекает с выделением осадка.
Сформулируйте вывод по работе.
Лабораторная работа № 4 Тема: Зависимость скорости взаимодействия соляной кислоты с металлами от их природы
Цель: Овладение умениями проведения химических реакций и навыками определения зависимости скорости химической реакции от концентрации, температуры и от природы вещества.
Задача: Закрепление знаний по теме «Химические реакции».
Оборудование и реактивы: Металлы Mg, Zn, Fe; растворы кислот 5% HCl,10% HCl, 20% HCl, H2SO4; оксид CuO (II). Штатив с пробирками, держатель, горелка, градусник.
Теоретические основы
Химические реакции происходят во времени и поэтому характеризуются той или иной скоростью. Многие химические реакции протекают мгновенно, т.е. превращение одних веществ в другие заканчивается в десятитысячные и миллионные доли секунды. Часто скорость одной и той же химической реакции изменяется в зависимости от условий. Чтобы судить о скорости химической реакции, надо знать, как изменяется концентрация в определенные промежутки времени. Концентрацию в данном случае выражают числом молей вещества, содержащегося в одном литре раствора. Если в течение промежутка времени (t) концентрации одного из реагирующих веществ уменьшилась от С1 до С2, то средняя скорость реакции за этот промежуток времени была:
V═ 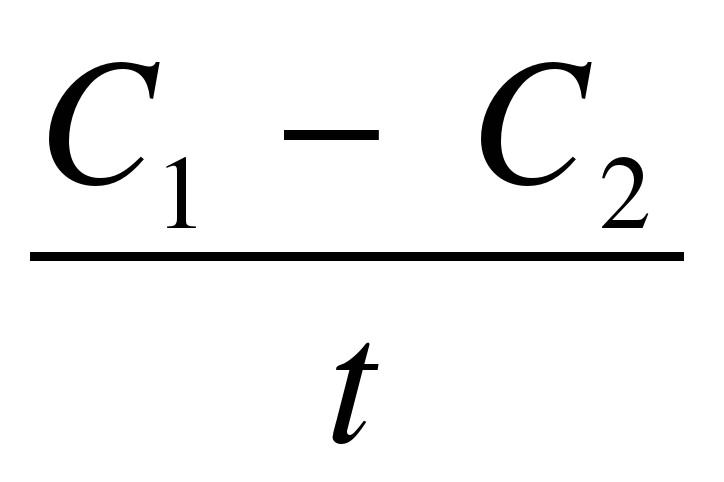
Скорость химических реакций зависит от концентрации участвующих в них веществ, температуры, катализатора, природы реагирующих веществ, величии поверхности соприкосновения веществ.
Давление влияет на скорость химических реакций не непосредственно, а через увеличение концентрации реагирующих веществ, находящихся в газообразном состоянии Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ. Этот закон, открытый Гульдбергом и Ваге в 1867 голу получил название закона действующих масс. Так для реакции: А + В = С
V ═ K[A] · [Β], где
V – скорость;
К – коэффициент пропорциональности или константа скорости,
[A] и [Β] – концентрации веществ А и В.
Константа скорости – величина постоянная для данной реакции. Она не зависит от времени и концентрации, а зависит от природы реагирующих веществ и температуры.
Известно, что многие химические процессы значительно ускоряются при повышении температуры, рост которой усиливает скорость движения молекул, увеличивая тем самым число столкновений между ними.
Как правило, в большинстве случаев повышение температуры на 100 скорость увеличивается от двух до четырех раз (правило Вант – Гоффа). Число, характеризующее ускорение реакции при нагревании на 100, называется температурным коэффициентом скорости.
Vt ═ Vt1 · γ 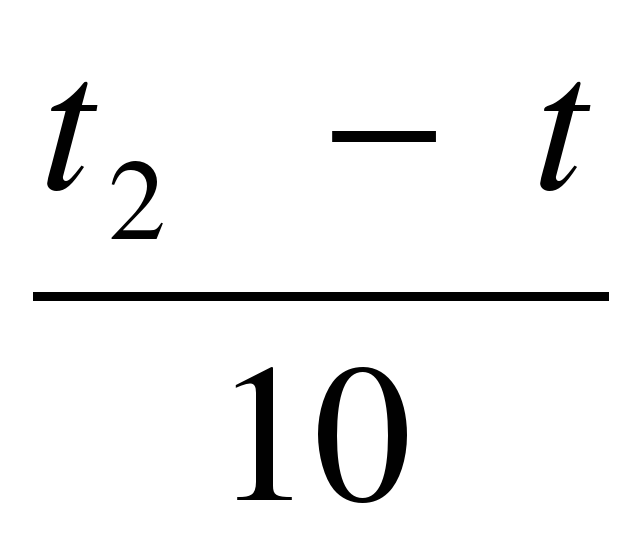 ,
,  где Vt1 – скорость реакции после повышения температуры до t2
где Vt1 – скорость реакции после повышения температуры до t2
Vt – начальная скорость реакции при температуры t1
γ – температурный коэффициент реакции, т.е. число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры реагирующих веществ на 10 градусов.
В обратимых реакциях, когда скорость прямой реакции равна скорости обратной реакции называется химическим равновесием. Переход из одного состояния равновесие в другое называется смещением химического равновесия. Правило смещения химического равновесия под влиянием давления, температуры и концентрации веществ сформулировал Ле-Шателье ( принцип Ле-Шателье): Если на систему, находящуюся в равновесии, произвести внешнее воздействие, то равновесие сместится в сторону, препятствующее этому воздействию.
Выполнение работы
1. Зависимость скорости взаимодействия соляной кислоты с металлами от их природы.
1.1. В пробирку поместите небольшое количество порошка Mg и прилейте 2мл
раствора HCl. Запишите наблюдения и химическую реакцию.
1.2. В пробирку поместите гранулу Zn и прилейте 2мл раствора HCl. Запишите наблюдения и химическую реакцию.
1.3. В пробирку поместите небольшое количество опилок Fe и прилейте 2мл раствора HCl. Запишите наблюдения и химическую реакцию. Сформулируйте зависимость скорости химической реакции от природы вещества.
2. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации.
В три пробирки налить растворы: в первую 3мл серной кислоты, во вторую 2мл серной кислоты и 1мл воды, в третью 1мл кислоты и 2мл воды. В каждую пробирку опустить гранулу цинка.
Запишите наблюдения. Сформулируйте зависимость скорости химической реакции от концентрации реагирующих веществ.
3. Зависимость скорости взаимодействия серной кислоты с оксидом меди (II) от температуры.
В две пробирки поместите небольшое количество порошка CuO и прилейте 2мл раствора H2SO4 в каждую пробирку. Одну из пробирок нагрейте. Запишите наблюдения и химическую реакцию. Сформулируйте зависимость скорости химической реакции от температуры реагирующих веществ.
Контрольные вопросы
1 уровень
1. Дайте определение скорости химической реакции?
2. Перечислите факторы, влияющие на скорость химической реакции.
3. Запишите выражение для скорости прямой и обратной реакции в химическом уравнении: 2SO2 + O2 ↔ 2SO3
2 уровень
1. Дайте определения закона действия масс.
2. Во сколько раз увеличится скорость в химической реакции
2SO2 + O2 ↔ 2SO3, если концентрацию реагирующих веществ увеличить в 3 раза?
3. Сформулируйте принцип Ле-Шателье.
3 уровень
1. Когда наступает химическое равновесие в обратимых реакциях?
2. Перечислите факторы, влияющие на смещение химического равновесия.
3. Определите, в какую сторону сместится равновесие в реакции
2SO2 + O2 ↔ 2SO3 +Q, если увеличить давление реагирующих веществ уменьшить температуру.
Лабораторная работа №5 Тема: Растворение глицерина в воде и взаимодействие с гидроксидом меди (II), глюкозы и сахарозы с гидроксидом меди (II)
Цель: Овладение навыками проведения химических опытов, с соблюдением правил техники безопасности, подтверждающих свойства глицерина, глюкозы, сахарозы, крахмала.
Задача: Закрепление знаний по теме «Кислородсодержащие органические соединения».
Реактивы и оборудование: Штатив с пробирками, держатель, горелка, стеклянная палочка. Растворы веществ: глицерина, уксусной кислоты, глюкозы, сахарозы, гидроксида натрия, сульфата меди (II), этилового спирта, серной кислоты. Раствор иода, крахмал, металлический магний, индикатор синий лакмус, вода.
Теоретические основы Спирты.
Химические свойства спиртов обусловлены в основном разрывом связи кислород – водород, а связь углерод – кислород остается незатронутой. Спирты амфотерны и обычно не являются ни сильными кислотами, ни сильными основаниями.
Спирты легко взаимодействуют с металлическим натрием:
C2H5OH + 2Na = 2C2H5ONa + H2
Многоатомные спирты взаимодействуют с нерастворимыми основаниями:
С Н2ОН H2C ─ O
Н2ОН H2C ─ O
│ │ Cu
│ Cu
СНОН + Cu(OH)2 → HC ─ O
│ │
СН2ОН H2C ─ OH + 2H2O
синий раствор – глицерат меди
3. При окислении этилового спирта в кислой среде образуется вещество – альдегид, содержащий альдегидную группу.
С2Н5ОН + О = СН3 ─ C ═ O
/
Н уксусный альдегид
Карбоновые кислоты.
Карбоновыми кислотами называются органические вещества, содержащие одну или несколько карбоксильных групп – СООН.
Химические свойства 1. при диссоциации образуют ионы водорода:
R ─COOH → R─COO- + H+
2. реагируют с активными металлами и их оксидами, со щелочами:
2СН3СООН + К = 2СН3СООК + Н2
ацетат калия
СН3СООН + КОН = СН3СООК + Н2О
3. взаимодействуют со спиртами с образованием сложных эфиров:
СН3 ─ C ═ O + Н ─ O ─ С2Н5 → СН3 ─ C ═ O + Н2О
│ │
ОН О ─ С2Н5
этиловый эфир уксусной кислоты
Углеводы.
Одним из наиболее распространенных моносахаридов является глюкоза, которая имеет молекулярную формулу С6Н12О6. В молекуле глюкозы объединяются свойства альдегида и многоатомного спирта, поэтому глюкозу называют альдегидоспиртом. Подобно многоатомным спиртам глюкоза с гидроксидом меди (II) образуется ярко-синий раствор
СН2ОН ─ (СНОН)4 ─ C ═ O + 2Cu(OH)2 = CH2OH ─ (CHOH)4 ─ C ═ O + Cu2O + 2H2O
При нагревании глюкозы с аммиачным раствором оксида серебра получается характерная реакция на альдегиды – «серебряное зеркало».
СН2ОН ─(СНОН)4 ─C ═ O + Ag2O → CH2OH ─(CHOH)4 ─ C ═ O + 2Ag
Под действием биологических катализаторов – ферментов – глюкоза способна превращаться в спирт – это так называемое спиртовое брожение.
С6Н12О6 → 2С2Н5ОН + 2СО2
Крахмал представляет собой белый амфотерный порошок, нерастворимый в холодной воде. В горячей воде крахмал сначала набухает, а затем дает вязкий раствор, который называется клейстером.
Крахмал является смесью полисахаридов, поэтому не дает реакций, свойственных моносахаридам. Он не обладает восстановительными свойствами – не образует красного осадка оксида меди (I).
При действии минеральных кислот крахмал гидролизуется до глюкозы.
(С6Н10О5)n + n H2O → nC6H12O6
Характерной реакцией на крахмал является реакция его с раствором иода - раствор окрашивается в интенсивный синий цвет.
Выполнение работы
1. Растворение глицерина в воде и взаимодействие с гидроксидом меди (II).
1.1. В пробирку прилейте 4мл воды и прилейте 2мл глицерина. Запишите наблюдения.
1.2. В пробирку прилейте 2мл раствора соли CuSO4 и 4мл раствора щелочи NaOH. К полученному осадку Cu(OH)2 прилейте раствор глицерина. Запишите наблюдения и химическую реакцию.
2. Свойства уксусной кислоты.
2.1. Диссоциация уксусной кислоты. В пробирку прилейте 2мл раствора CH3COOH и добавьте 1 каплю синего лакмуса. Запишите наблюдения и химическую реакцию.
2.2. Взаимодействие уксусной кислоты с активным металлом. В пробирку поместите небольшое количество Mg и прилейте 2мл раствора CH3COOH. Запишите наблюдения и химическую реакцию.
2.3.Взаимодействие уксусной кислоты со спиртом. В пробирку прилейте 2 мл уксусной кислоты, 2 мл этилового спирта и 2 мл конц. серной кислоты. Смесь перемешайте и медленно нагрейте, но не кипятите. Обратите внимание на появившийся запах. Запишите наблюдения. Полученную горячую смесь перелейте в пробирку с насыщенным раствором хлорида натрия. Запишите наблюдения и химическую реакцию получения эфира.
3. Взаимодействие глюкозы и сахарозы с гидроксидом меди (II).
В одну пробирку прилейте раствор глюкозы а, в другую пробирку раствор сахарозы и в каждую пробирку добавьте заранее приготовленный гидроксид меди (II). Запишите наблюдения и химическую реакцию взаимодействия глюкозы с Cu(OH)2.
Затем обе пробирки нагрейте до кипения. Запишите наблюдения и химическую реакцию
взаимодействия глюкозы с Cu(OH)2 при нагревании.
4. Качественная реакция на крахмал.
В пробирку поместите небольшое количество порошка крахмала и прилейте 4мл воды все перемешайте стеклянной палочкой и нагрейте до кипения. Полученный крахмальный клейстер остудите, и добавьте 1 каплю раствора иода. Запишите наблюдения.
Контрольные вопросы
1уровень
1. Почему глицерин в отличие одноноатомных спиртов взаимодействует с основанием?
2. Почему глюкоза проявляет свойства альдегидов и спиртов?
3. Почему сахароза не дает реакцию «серебряного зеркала»?
2 уровень
1. Как можно обнаружить в растворах глицерин?2
2.Почему сахароза с аммиачным раствором оксида серебра не дает положительный результат.
3. Как можно обнаружить крахмал в продуктах питания?
3 уровень
1. Как можно обнаружить глюкозу и глицерин в пробирках без надписи.
2. Запишите реакцию спиртового брожения глюкозы.
3. Осуществите превращение: CO2 → C6H12O6 → C2H5OH → CO2
Сформулируйте вывод по работе. Лабораторная работа №6 Тема: Доказательство непредельного характера жидкого жира. Качественная реакция на крахмал. Цель: Ознакомиться со свойствами жиров, омылением, сравнительных свойств мыла и синтетических моющих средств (с.м.с.) Оборудование: Штативы с пробирками, вода, уксусная кислота (концентрированная), органические растворители – бензин, ацетон и др. эфиры, растворительный жир и др. жиры. Мыло – твердое и (смс) любые. Спиртовки, фенол – фталин, СаСl2 Н2SO4, HCl, бромная вода, фарфоровые чашечки, тринежки, NaОН, спирт, стеклянные палочки, стаканы и цилиндр. Опыт 1: свойства жиров.
В пробирку налить: воды, бензина, эфира, ацетона и др. жидкости, добавить кусочек жира или несколько капель растительного жира, все тщательно взболтать, наблюдать в какой пробирке растворился жир.
Опыт 2: свойства мыла.
Мелко настругать мыло и растворить в воде, нагревая воду. Мыльный раствор разлить в пробирки. В одну прилить 2 – 3 капли фенолфталина, в другую равный объем серной или соляной кислоты, в третью столько же раствора хлористого кальция. Наблюдать, что происходит и записать реакции в молекулярном и ионном виде.
Опыт 3: доказательства непредельного характера жиров.
В одну пробирку налить2 мл. подсолнечного масла, во вторую поместить кусочек твердого жира (нагреть). К содержимому всех пробирок добавьте немного бромной воды. Что наблюдается?
Опыт 4: омыление жиров.
В фарфоровую чашечку поместить 3г. жиров, маргарина, или сливочного масла и прилейте 7 – 8 мл. раствора, содержащего в массовых долях 0,2 NаОН. Для ускорения реакции добавить 1 – 2 мл. этанола. Смесь кипятить 15 мин., помешивая стеклянной палочкой и добавляя воду до исходного уровня. Проверить омыление так: если при охлаждении на поверхности воды не всплывают капельки жира (омыление прошло).
Опыт 5: сравнительные свойства мыла и синтетических моющих средств.
Приготовить в 3 колбах по 50 мл. разбавленных растворов: мыла, порошка.
Влейте по 2-3 мл. приготовленных растворов в пробирки, добавьте несколько капель растворов фенолфталеина. Наблюдайте появление малиновой окраски.
Опыт 6: синтез этилового эфира уксусной кислоты.
В пробирку налейте 1-2 мл. концентрированной уксусной кислоты и столько же этанола, добавьте 0,5 мл. концентрированной серной кислоты. Смесь этих веществ перемешивайте в течении 4-5 минут. Осторожно нагрейте, не доводя до кипения. Затем содержимое пробирки охладите, и вылейте в другую пробирку с водой.
Контрольные вопросы
Что такое омыление и для каких целей используется процесс омыления жиров?
Почему раствор мыла имеет щелочную реакцию?
Что называется реакцией этерификации?
О чем свидетельствует осветление бромной воды?
Составьте уравнения реакции между: метиловым спиртом и уксусной кислотой пропиловым спиртом и масляной кислотой
Назовите полученные соединения.
Лабораторная работа №7
Тема: Растворение белков в воде. Обнаружение белков в молоке и мясном бульоне.
Цель: Овладение навыками проведения химических опытов, подтверждающих свойства белков и их нахождение в продуктах питания.
Задача: Закрепление знаний по теме «Азотсодержащие органические соединения. Полимеры».
Оборудование и реактивы: Штатив с пробирками, держатель, горелка, спички. Раствор нитрата свинца, молоко, мясной бульон, этиловый спирт, раствор сульфата меди (II), раствор щелочи NaOH.
Теоретические основы
Белками или белковыми веществами, называют высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью. Белки - амфотерные электролиты. При определенном значении рН среды число положительных и отрицательных зарядов в молекуле белка одинаково. Это одно из основных свойств белка.
Под действием внешних факторов (температуры, механического воздействия, действия химических агентов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы. Первичная структура, а следовательно, и химический состав белка не меняется.
Выполнение работы
1. Растворение белков в воде.
В пробирку с водой поместите немного куриного бека и перемешайте стеклянной палочкой. Запишите наблюдения.
2. Обнаружение белков в молоке и мясном бульоне.
В одну пробирку прилейте 4мл молока а, в другую пробирку 4мл мясного бульона и в каждую пробирку добавьте 4мл щелочи NaOH и 2мл раствора соли CuSO4. Появление характерного фиолетового окрашивания указывает на наличие белка. Запишите наблюдения.
Контрольные вопросы
1. Какой состав имеет молекула белка?
2. Какова структура белковой молекулы?
3. Какие химические соединения в организме используются для синтеза белков?
4. Какие цветные реакции доказывают наличие белка?
Сформулируйте вывод по работе.
Лабораторная работа №8 Тема: Денатурация раствора белка куриного яйца спиртом, растворами солей тяжелых металлов и при нагревании.
Цель: изучение свойств белка;
Оборудование: пробирки, подставки для пробирок, спиртовка;
Реактивы: раствор белка, сульфат меди- CuSO4, ацетат свинца- Pb(CH3COO)2∙3 H2O ;
Инструкция по технике безопасности
1.Перед выполнением работы внимательно прочитать ее описание.
2.Осторожно обращайтесь с растворами. При их разливе немедленно сообщите лаборанту или преподавателю. Самостоятельно не убирайте!
3.Пробирки нагревайте равномерно.
4. Осторожно, по стенке приливайте раствор серной кислоты на воду, беспрерывно перемешивая раствор.
5. При попадании на кожу раствора кислот или щелочей поставьте в известность преподавателя, промойте пораженное место большим количество проточной воды из под крана, затем раствора соды или борной кислоты.
6. После выполнения работы осторожно уберите оборудование и реактивы на демонстрационный стол. Тщательно вымойте руки мылом.
Теоретическая часть
Белки –это природные полимеры, которые играют ключевую роль почти во всех структурах живых организмов и происходящих в них процессах. Белки выполняют различные биологические функции: каталитическую, транспортная, регуляторная, энергетическая, двигательная, структурная, защитная. Белки играют роль биологических катализаторов ( ферменты).
Ход работы
1. Приготовьте раствор белка. Для этого белок куриного яйца растворите в 150мл воды. В пробирку налейте 4-5 мл раствора белка и нагрейте на горелке для кипения. Отметьте помутнение раствора. Охладите содержимое пробирки. Разбавьте водой в 2 раза.
Почему раствор белка при нагревании мутнеет?
Почему образующийся при нагревании осадок не растворяется при охлаждении и разбавлении водой?
2. В две пробирки налейте по 1-2 мл раствора белка и медленно, при встряхивании, по каплям добавьте в одну пробирку насыщенный раствор медного купороса, а в другую- раствор ацетата свинца. Отметьте образование труднорастворимых солеобразных соединений белка. Данный опыт иллюстрирует применение белка как противоядие при отравлении солями тяжелых металлов.
Правила безопасности в химической лаборатории.
Запрещается пробовать на вкус химические вещества.
Щелочи, кислоты и другие ядовитые вещества необходимо набирать в пипетку только при помощи резиновой груши.
При взбалтывании растворов в колбах или пробирках необходимо закрывать их пробкой.
При нагревании жидкостей пробирку следует держать отверстием в сторону от себя и соседей по работе.
Во избежание ожогов от брызг и выбросов не наклоняться над сосудом, в котором кипит или налита какая-либо жидкость.
При переносе сосудов с горячими жидкостями держать их обеими руками: одной поддерживать дно, другой – верхнюю часть.
При работе с горячими и легковоспламеняющимися веществами (эфиры, спирты, бензин) нельзя нагревать их на открытом огне или сетке.
При определении запаха вещества не следует делать глубокого вздоха, а лишь движением руки направлять к себе воздух.
Концентрированную серную кислоту следует приливать в воду тонкой струей при непрерывном помешивании.
Химические стаканы, колбы из обычного стекла нельзя нагревать на голом огне без асбестовой сети. Категорически запрещается использовать посуду, имеющую трещины или отбитые края.
Использованную химическую посуду и приборы, содержащие кислоты, щелочи и другие едкие вещества, нужно освобождать от остатков и тщательно мыть. Прежде чем слить в раковину, их нужно нейтрализовать.
Нельзя оставлять без присмотра работающие установки, включенные электронагревательные приборы, спиртовки.
При обнаружении дефектов в приборах немедленно сообщите преподавателю, студентам запрещается устранять неисправности.
Если разбит ртутный термометр или электрод, содержащий ртуть (о случившемся сообщить преподавателю), рекомендуется капли ртути собрать амальгамированными пластинками из белой жести или меди. После удаления капель ртути необходимо залить место ее разлива 20%-ным раствором хлорида железа (III).
Во избежание отравлений категорически запрещается принимать пищу в химической лаборатории.
При мытье химической посуды запрещается работать с хромовой смесью без резиновых перчаток и защитных очков, а также прорезиненного фартука
Оказание первой медицинской помощи
При термических ожогах осторожно обнажить обожженный участок и закрыть сухой асептической повязкой. Обожженный участок нельзя как-либо очищать и мочить водой, этиловым спиртом, перекисью или смазывать мазью.
При химических ожогах промыть обожженное место, не обращая внимания на боль, большим количеством проточной воды (10 – 15 мин), в случае кислых реагентов – раствором бикарбоната натрия (2%-ным), а в случае щелочных – разбавленным раствором борной или уксусной кислот.
При порезах стеклом:
а) промыть рану можно только в случае попадания в нее едких или ядовитых веществ, в остальных случаях, даже если в рану попал песок, ржавчина, промыть ее водой нельзя;
б) нельзя смазывать рану мазями; перед наложением повязки смазать настойкой йода участок вокруг раны;
в) удалять из раны мелкие осколки стекла может только врач.
При отравлении химическими веществами немедленно вызвать врача и одновременно приступить к оказанию первой помощи – если яд попал внутрь – вызвать рвоту, дать противоядие.
В лаборатории должен быть список веществ, вызывающие отравление и применяемые противоядия.
В лаборатории должна быть аптечка с набором медикаментов.
Список литературы
1. Ерохин Ю.М. Химия: учебник. - М., ОИЦ «Академия», 2011.
2. Габриелян О.С. Химия: учебное пособие для студентов профессиональных учебных заведений / О.С. Габриелян, И.Г. Остроумов. – М., ОИЦ «Академия»,2011
3. Габриелян О.С. Химия в тестах, задачах, упражнениях: учебное пособие для студентов средних профессиональных учебных заведений / О.С. Габриелян, Г.Г.Лысова – М., ОИЦ «Академия», 2011.
4. Габриелян О.С. Практикум по общей, неорганической и органической химии: учебное пособие для студентов средних профессиональных учебных заведений / О.С.Габриелян, И.Г.Остроумов. – М., ОИЦ «Академия», 2010.
5. Габриелян О.С., Остроумов И.Г. Химия: учебник. – М., ОИЦ «Академия», 2011.

 Получите свидетельство
Получите свидетельство Вход
Вход





 Н2ОН H2C ─ O
Н2ОН H2C ─ O │ Cu
│ Cu 








 Методические рекомендации по выполнению практических и лабораторных работ (0.42 MB)
Методические рекомендации по выполнению практических и лабораторных работ (0.42 MB)
 0
0 897
897 107
107 Нравится
0
Нравится
0


