Лекция 2.
Периодический закон и Периодическая система химических элементов Д.И. Менделеева,
строение атома
Составитель: преподаватель химии, биологии
Кутлиметова Зурета Ахмедовна
с. Красногвардейское – 2023
Лекция 2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева, строение атома
План
Структура Периодической системы
Строение атома
История открытия Периодического закона
Периодические закономерности изменения свойств элементов по периодам и группам
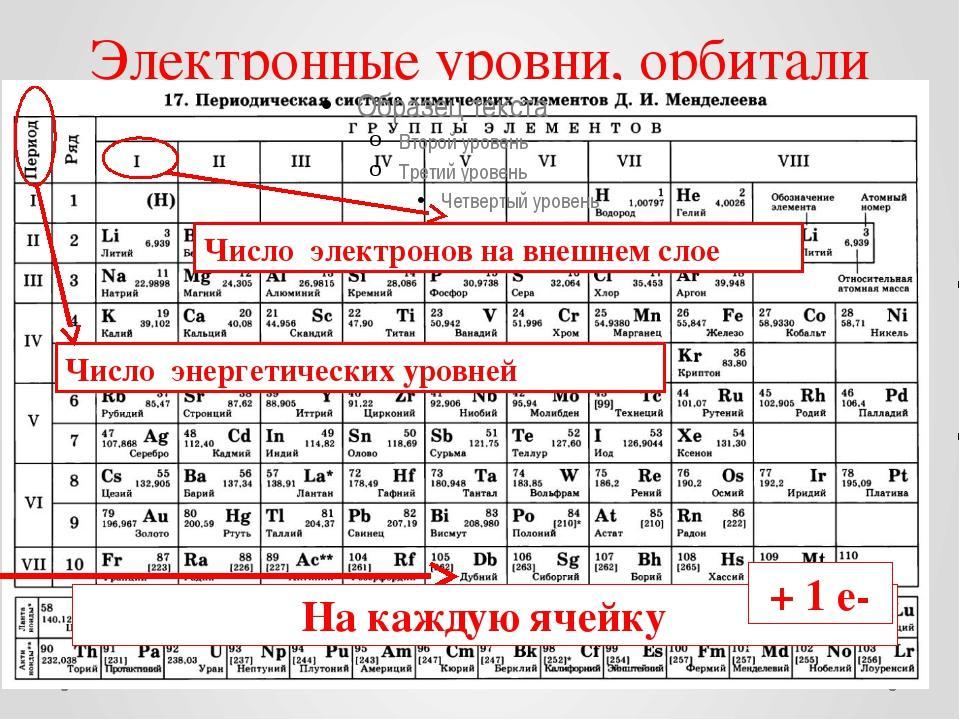
Структура Периодической системы
Периодическая система Д. И. Менделеева является графическим отображением Периодического в том, что ученые заполняли пустые клетки в таблице Менделеева: открыли семейство благородных газов. Открывались естественно и искусственно полученные радиоактивные элементы. В 2010 году был открыт последний 117 химический элемент 7 периода Периодической системы.
Таким образом, перед учеными встал вопрос о нижней границе Периодической системы, который остается открытым до сих пор.
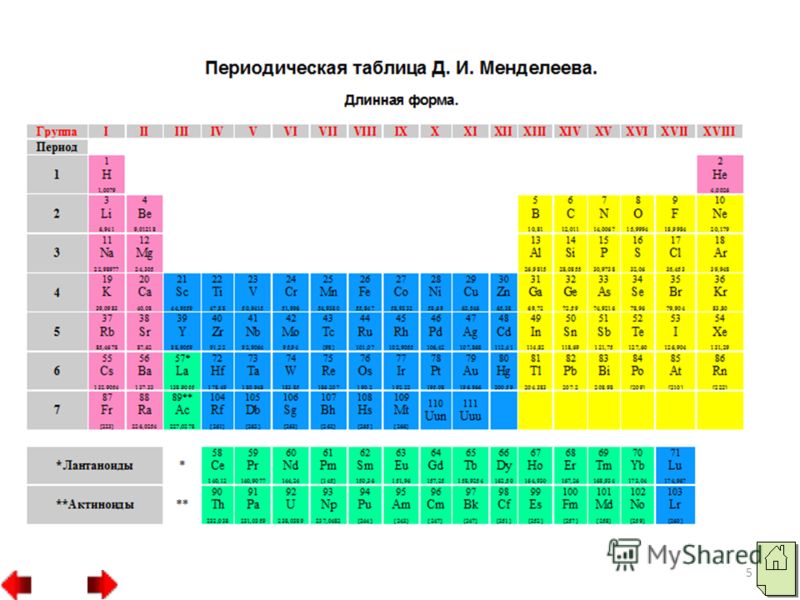
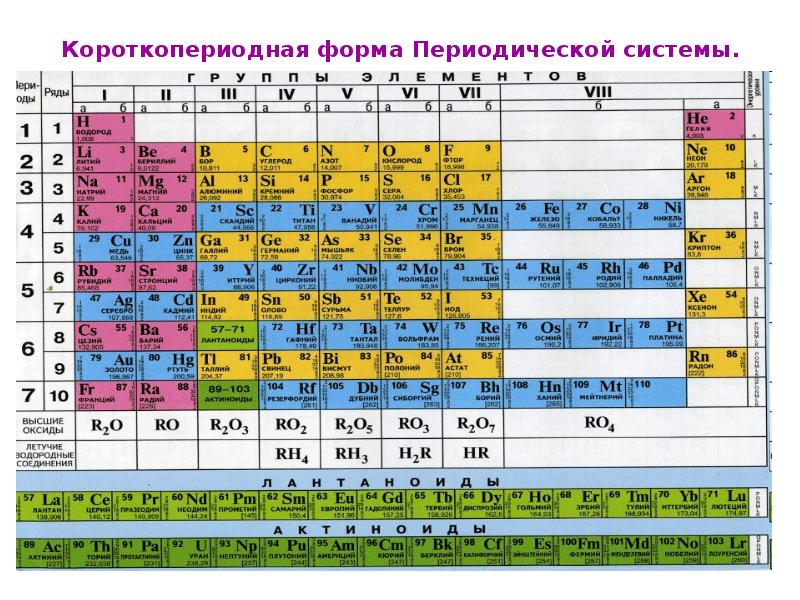
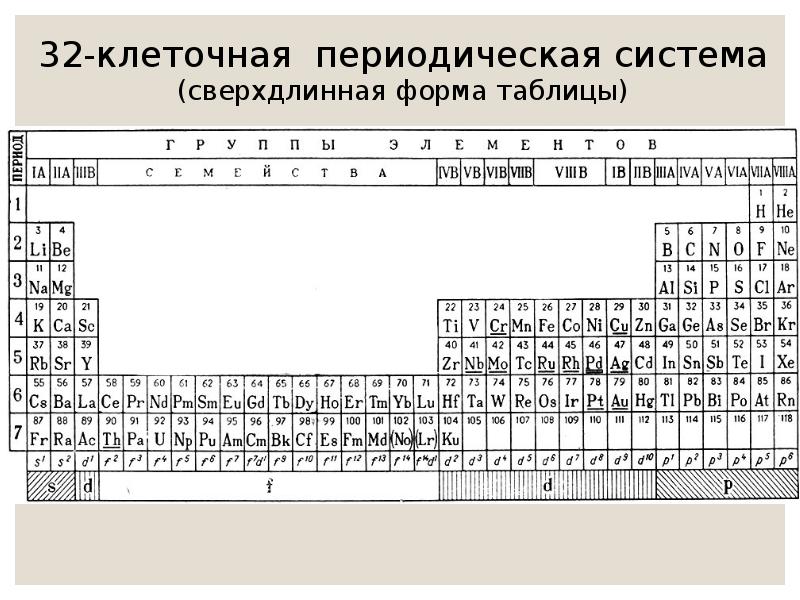
Чаще всего можно увидеть три формы выражения Периодической системы: короткая или короткопериодная, длинная или длиннопериодная или сверхдлинная.
В короткопериодной форме 1-3 периоды занимают по 1 строке, 4-ый и последующие периоды занимают по 2 строчки. Символы элементов главных и побочных подгрупп выравниваются относительно разных краев клеток. Лантаноиды и актиноиды вынесены из общей таблицы.
В длинном варианте лантаноиды и актиноиды вынесены из общей таблицы, соответственно, так же как и в короткой, делая её более компактной. Нет главных и побочных подгрупп. Каждый период занимает ровно одну строчку.
К аждая клеточка Периодической системы содержит символ одного химического элемента, у которого указан порядковый номер и значения относительной атомной массы элемента.
аждая клеточка Периодической системы содержит символ одного химического элемента, у которого указан порядковый номер и значения относительной атомной массы элемента.
Период начинается щелочным металлом и заканчивается инертным газом.
Всего периодов семь. Исключением является 1-ый период. В его состав входит только 2 химических элемента: водород, который не считается щелочным металлом, и гелий.
1-ый, 2-ой, 3-ий периоды называются малыми. Они содержат 2 и 8 химических элементов и состоят из одного ряда.
4-7 периоды называются большими. 4-ый и 5-ый периоды включают в себя 18 элементов. 6-ой и 7-й состоят из 32 элементов. В 6-ом и 7-ом периодах есть группы, состоящие из 14 элементов. В 6-ом периоде эти элементы схожи по свойствам с лантаном, а в 7-ом – с актинием. Эти элементы вынесены за основную таблицу и называются лантаноиды и актиноиды. Они обладают одинаковыми свойствами.
Совокупность переходных металлов в каждом периоде называется вставной декадой, потому что этих металлов в каждом периоде 10.
Группой называется вертикальный ряд химических элементов. Все элементы группы имеют одинаковое число валентных электронов.
Группы в короткой форме таблицы делятся на главную «А» и побочную «Б» подгруппы.
В каждой главной подгруппе с ростом порядкового номера элемента химические свойства меняются от неметаллических на металлические.
В побочную подгруппу включаются только металлы, называемые переходными элементами.
Если подгруппа начинается элементами малого периода – это главная подгруппа. Подгруппа, которая начинается элементами большого периода, – это побочная подгруппа. Например, рассмотрим II группу периодической системы.
Бериллий Be – элемент 2-го периода.
Он начинает столбик элементов главной подгруппы. В её состав входят: Be. Mg, Ca, Sr, Ba, Ra.
Цинк Zn начинает побочную подгруппу, так как он входит в состав 4-го периода. В побочную подгруппу входит Zn, Cd, Hg.

Рис. 1. Химический элемент бром
Рассмотрим элемент Br (рис. 1). Его порядковый номер – 35, относительная атомная масса – 80. Находится в 4-ом периоде, в 7-ой главной подгруппе.

Рис. 2. Химический элемент платина
Рассмотрим элемент платину (рис. 2).
Символ – Pt, порядковый номер – 78, относительная атомная масса – 195. Находится в 6-м периоде, в 8-й побочной подгруппе.
В состав каждой группы входит элементы с одинаковым числом валентных электронов. Следовательно, они будут обладать схожими химическими свойствами.
Это отражается в названии некоторых групп элементов.
Например, элементы главной подгруппы 1-ой группы – Li, Na, K, Rb, Cs, Fr – называются щелочные металлы.
Элементы главной подгруппы 2-ой группы – Ca, Sr, Ba, Ra – называются щелочноземельные металлы.
Халькогены O, S, Se, Te, Po – элементы 6-й группы главной подгруппы.
Галогены: F, Cl, Br, J, At – элементы 7-й группы главной подгруппы.
8-ю главную подгруппу называют подгруппой инертных или благородных газов. Это He, Ne, Ar, Kr, Xe, Ra.
Химические свойства в периодах меняются с металлических через амфотерные на неметаллические. Таким образом, зная химические свойства элемента, можно предположить, где конкретно он находится в Периодической системе. И наоборот, если знать положение элемента в Периодической системе, можно предположить его химические свойства.
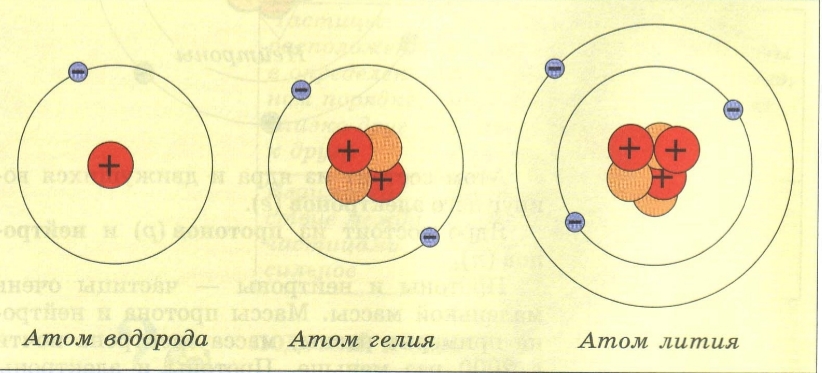
Строение атома
Физический смысл порядкового номера элемента: в 1913 г. Английский физик Г. Мозли установил, что положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Д.И. Менделеева. Порядковый номер ХЭ = заряд ядра атома = протоны = электроны
Протоны (p) электроны (е)
Нейтроны (n)

Ядро атома электронная оболочка атома
ma(p) = 1,6726 · 10-27 кг ma(n) = 1,6750 · 10-27 кг ma(e) = 9,11 · 10-31 кг
Ar(p) = 1 Ar(n) = 1 Ar(e) = 1/1840
Вся масса атома сосредоточена в его ядре, т.е. масса атома равна массе ядра, определяется суммой протонов и нейтронов.
A=Z+N
A – массовое число атома,
Z – число протонов,
N – число нейтронов.
Изотопы – атомы одного элемента, которые имеют разные массовые числа
(разное число нейтронов).
1Н 2Н 3Н
протий дейтерий тритий
1p 1p 1p
0n 1n 2n
В природе различные элементы имеют разное число изотопов с разным процентным содержанием каждого из них. Относительная атомная масса, приведенная в периодической системе это, и есть средняя величина массовых чисел изотопов с учетом распространенности.
35Cl (75,47%) 37Cl (24,53%)
Ar(Cl) = (35·75,47+37·24,53) / 100 = 34,453

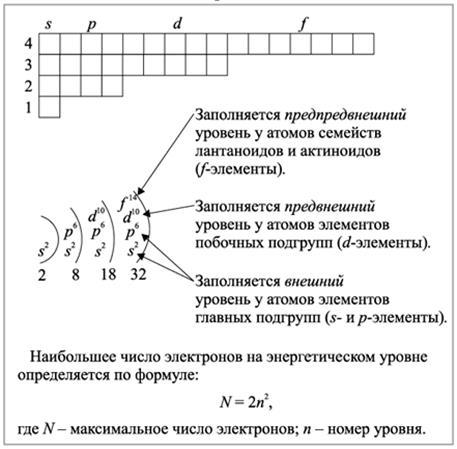
электронная оболочка == энергетические уровни == энергетические подуровни == атомные орбитали
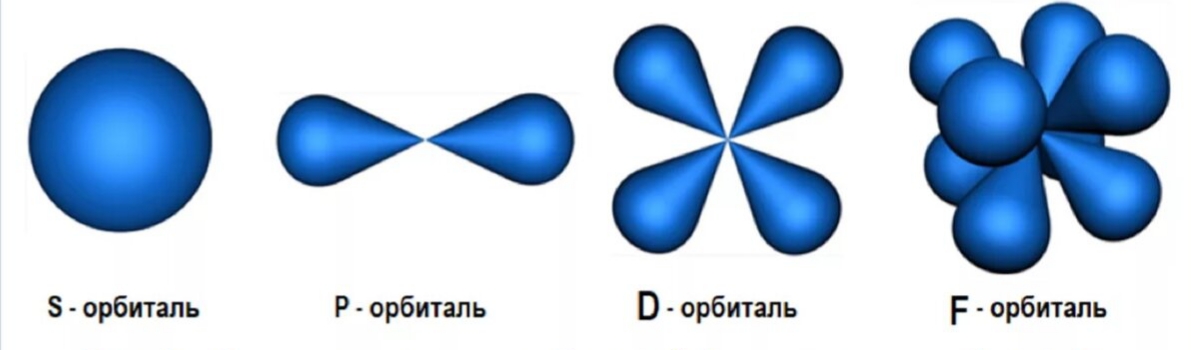
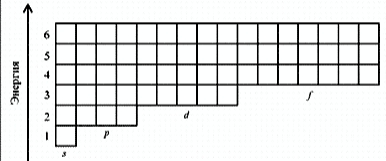
Энергетическая диаграмма расположения атомных орбиталей в электронной оболочке
Состояние электрона в атоме описывается набором 4-х квантовых чисел:
1) Главное к.ч. (n) – энергия и размер орбитали на уровне.
Значения: 1 2 3 4 5 6 7
Э нергия и размер орбиталей
нергия и размер орбиталей
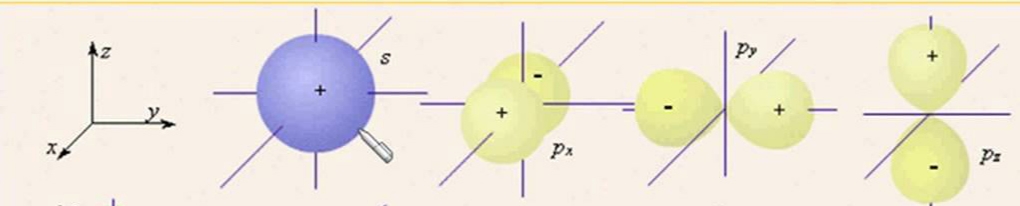
2) Орбитальное или побочное к.ч. (l) – запас энергии электрона на подуровне и форму электронного облака.
Значения: 0 1 2 3
s p d f
3) Магнитное к.ч. (m) – направление электронного облака в пространстве по отношению к магнитным полюсам.
Значения: -l…0…+l
4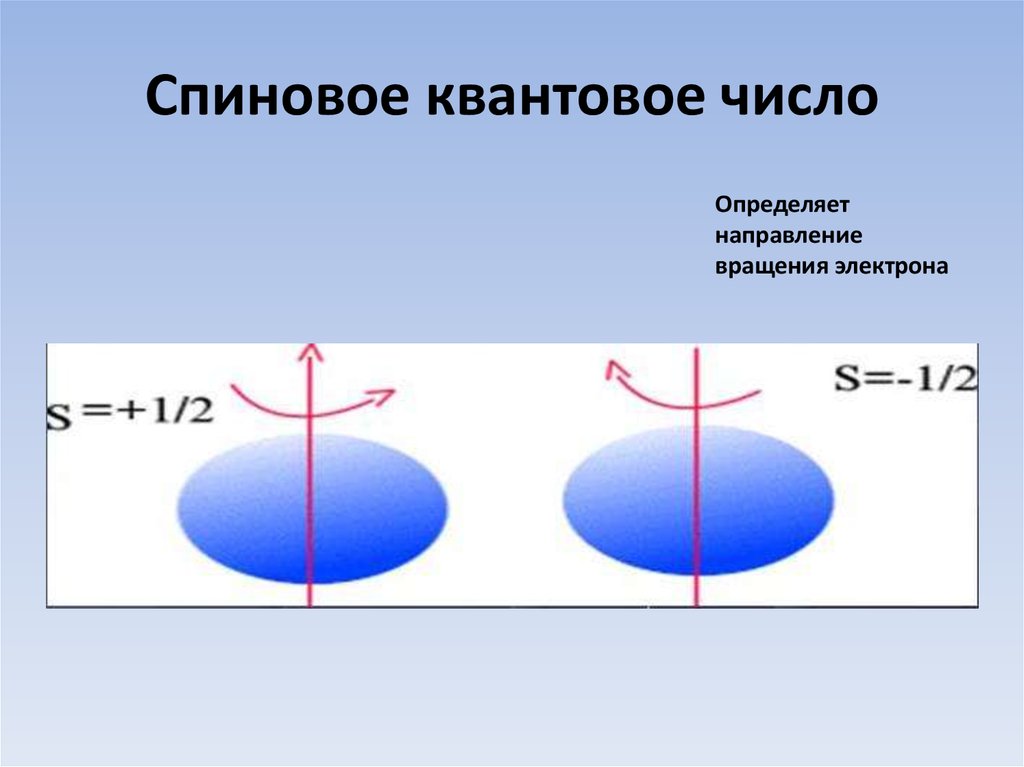 ) Спиновое к.ч. (s) – собственный вращательный момент электрона, т.е. вращение вокруг своей оси.
) Спиновое к.ч. (s) – собственный вращательный момент электрона, т.е. вращение вокруг своей оси.
Значения: +1/2; -1/2
+1/2 – по часовой стрелке ↑
-1,2 – против часовой стрелки ↓
Правила заполнения энергетических уровней, подуровней, атомных орбиталей
1) Принцип наименьшей энергии:
Электрон стремится на тот уровень и подуровень, нахождение на котором требует наименьшей энергии.
2) Принцип запрета Паули:
- в атоме не может быть даже 2-х электронов, обладающих одинаковым набором всех 4-х к.ч., они должны хотя бы различаться спинами;
- на одной атомной орбитали не может находиться более двух электронов.
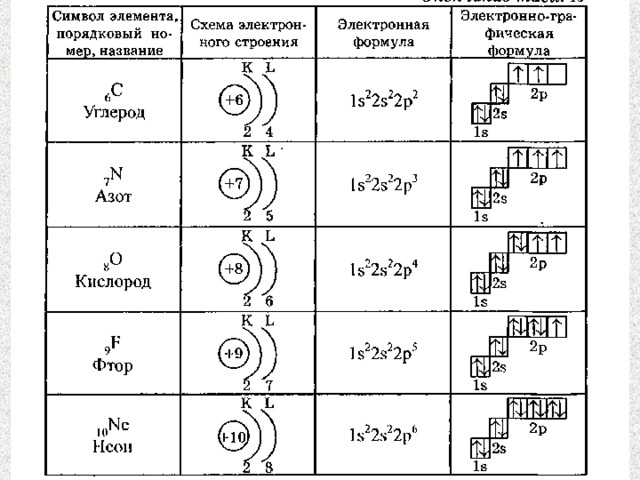
3) Правило Гунда:
Электроны распределяются в пределах подуровня таким образом, чтобы суммарное значение спинов было максимальным.

4) Правило Клечковского:
- электроны на уровне и подуровне распределяются таким образом, чтобы сумма значений n и l к.ч. была минимальной;
- если для каких-то состояний электрона эта сумма одинакова, то электрон стремится туда, где значение n – меньшее.
1s | 2s 2p | 3s 3p | 4s 3d 4p | 5s 4d 5p | 6s 4f 5d 6p| 7s…
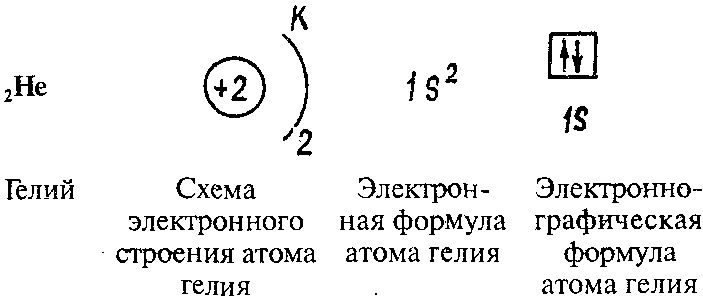
Периодический закон
В истории человеческих знаний немало подвигов. Но очень немногие из них можно сопоставить с тем, что было сделано Дмитрием Ивановичем Менделеевым. Величие научного подвига Менделеева не только не стирается временем, но продолжает расти. И никто не может сказать, будет ли когда-нибудь исчерпано до конца все содержание одного из величайших в науке обобщений — периодического закона Менделеева.
История строго и придирчиво отбирает и сортирует всё, что найдено и создано человеком. Поразительная, ставшая привычной четкость таблицы Менделеева наших дней скрывает от нас гигантскую работу учёного по осознанию всего, что было известно до него о превращениях вещества, работу, благодаря которой стала осуществимой великая интуитивная догадка о существовании нового закона — закона периодичности свойств химических элементов.
Законы природы, открытые человеком, различны по объему познанного и по тому, в каких областях познания мира они действенны. Их трудно сравнивать между собой. Но законы сравнимы по самому главному — по возможности предсказания нового, предвидения неизвестного. Периодический закон в этом отношении не имеет равных в истории науки. Менделеев указал путь направленного поиска в химии будущего. Многие ученые, основываясь на периодическом законе, предсказывали и описывали неизвестные химические элементы и их свойства.
История химии не знает подобного триумфа. Открыт новый закон природы. Вместо разрозненных, не связанных между собой веществ перед наукой встала единая стройная система, объединившая в одно целое все химические элементы. Но Менделеев поставил перед наукой еще более грандиозную задачу: объяснить взаимную связь между всеми элементами, между их физическими и химическими свойствами.
Закон Менделеева оказал огромное влияние на развитие знаний о строении атома, о природе вещества. В свою очередь, успехи атомной физики, появление новых методов исследования, развитие квантовой механики расширили и углубили сущность периодического закона и периодической системы элементов.
Открытие закона периодичности — величайшая веха в развитии химии. Историки науки часто выделяют два периода в этом развитии: до закона и после закона.
Что было накануне открытия?
Было известно 63 химических элемента. Далеко не все свойства этих элементов были достаточно изучены, даже атомные веса некоторых были определены неправильно или неточно. Много это или мало — 63 элемента? Если вспомнить, что сейчас мы знаем 118 элементов (на 2016 г.), то, конечно, маловато. Но вполне достаточно, чтобы можно было подметить закономерность изменения их свойств. При 30 или 40 известных химических элементах едва ли удалось что-либо открыть. Нужен был определенный минимум открытых элементов. Вот почему мы вправе охарактеризовать менделеевское открытие как своевременное.
Но разве до Менделеева не пытались ученые подчинить все известные элементы определенному порядку, классифицировать их, свести в систему?
Многие пытались. Сказать, что их попытки были бесполезными, нельзя: какие-то крупицы истины они содержали. Например, в 1829 г. немецкий химик И. Дёберейнер сгруппировал элементы со сходными химическими свойствами по тройкам: литий, натрий, калий; хлор, бром, йод и т. д. Он назвал эти группы триадами. Позже совокупности таких элементов стали именовать естественными группами.
В 1849 г. классификацией элементов заинтересовался видный русский химик Г.И. Гесс. В учебнике «Основания чистой химии» он описывал четыре группы элементов-неметаллов с похожими химическими свойствами:

Гесс писал: «Эта классификация еще очень далека от того, чтобы быть естественной, но она все-таки соединяет элементы и группы весьма сходные, и с расширением наших сведений она может усовершенствоваться».
Одну из попыток классификации сделал в 1862 г. француз А. Бегье де Шанкуртуа. Систему элементов он представлял в виде спиральной линии на поверхности цилиндра. На каждом витке по 16 элементов. Сходные элементы располагались друг под другом на образующей цилиндра. Но никто из ученых не обратил внимания на работу де Шанкуртуа.
Английский химик А. Ньюлендс в 1866 г. предложил так называемый закон октав. Он считал, что всё в мире подчиняется общей гармонии. И в химии и в музыке она должна быть единой. Поэтому свойства химических элементов, расположенные по возрастанию атомного веса, должны повторяться через каждые семь элементов, так же как и в музыкальной гамме сходные ноты чередуются в октаве через каждые семь нот. По закону октав однако, оказывались сходными такие совершение различные элементы, как углерод и ртуть.
Когда Ньюлендс доложил о своей работе на заседании Лондонского химического общества, один из присутствующих не без сарказма спросил: не пробовал ли уважаемый докладчик расположить элементы в алфавитном порядке и не обнаружил ли он при этом какую-нибудь закономерность?
Ближе других к истине оказались, пожалуй, английский ученый В. Одлинг и немецкий Л. Мейер. Так, в 1864 г. Л. Мейер предложил таблицу в которой все известные химические элементы были разбиты на шесть групп, согласно их валентности. По внешнему виду таблица Мейера была немного похожа на будущую менделеевскую. Но ни она, ни все другие предшествующие классификации не содержали главного: они не отражали общей, фундаментальной закономерности изменения свойств элементов. Они создавали лишь видимость порядка в их мире. Тот же недостаток был присущ и таблицам Одлинга.
Предшественники Менделеева, подметившие частные проявления великой закономерности в мире химических элементов, по разным причинам не смогли подняться до великого обобщения и осознать существование в мире фундаментального закона. Почему же именно Дмитрию Ивановичу Менделееву удалось открыть периодический закон? И как было сделано это открытие?
«Опыт системы элементов…»
17 февраля (по старому стилю) 1869 г., собираясь в дорогу, профессор Петербургского университета Дмитрий Иванович Менделеев на обороте письма, в котором его просили приехать и помочь производству, сделал первый набросок таблицы химических элементов. В этой таблице он расположил элементы в порядке возрастания их атомных весов и проследил периодическую повторяемость их свойств.
В тот день Менделеев отложил свою поездку. Он написал на отдельных карточках все известные тогда элементы с их важнейшими химическими и физическими свойствами. Располагая эти карточки в различном порядке, сообразуясь с атомными весами элементов, с их свойствами и со свойствами их соединений, Менделеев составил первый вариант системы химических элементов. Он назвал его «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». 1 марта 1869 г. Менделеев разослал многим русским и иностранным ученым отпечатанный в виде таблички «Опыт системы…».
Первая таблица еще очень несовершенна, она далека от современного вида периодической системы. Но эта таблица оказалась первой графической иллюстрацией открытой Менделеевым закономерности: «Элементы, расположенные по величинам их атомного веса, представляют явственную периодичность свойств». Эти слова взяты из статьи Менделеева «Соотношение свойств с атомным весом элементов». Она явилась итогом размышлений Менделеева в ходе работы над «Опытом системы…».
Менделеев в этой статье ни разу прямо не употребляет термин «периодический закон». Как всякий великий ученый, он был скромен и осторожен в конечных выводах. То, что он действительно открыл фундаментальный закон природы, ему было ясно с самого начала. Но чтобы обнаруженная закономерность могла называться законом и была признана другими учеными как закон, для этого, чувствовал Менделеев, надо было еще много работать. И два с половиной года — вплоть до декабря 1871 г. он занимался разработкой своего открытия.
Первое сообщение об открытии было сделано 6 марта 1869 г. на заседании Русского химического общества. Менделеева на этом заседании не было. Вместо отсутствовавшего автора его доклад прочитал химик Н.А. Меншуткин. В протоколах Русского химического общества появилась сухая запись о собрании 6 марта 1869 г.: «Н. Меншуткин сообщает от имени Д. Менделеева «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». За отсутствием Д. Менделеева обсуждение этого вопроса отложено до следующего заседания».
Этот сухой канцелярский протокол стал историческим документом огромной важности, свидетельством о первом знакомстве человечества с новым законом природы. Но многие ученые, современники Менделеева, впервые услышавшие и узнавшие об этой системе элементов, не смогли её сразу понять.
В чем заключался решающий шаг?
Менделеев видел три обстоятельства, которые, по его мнению, способствовали открытию периодического закона:
во-первых, были более или менее точно определены величины атомных весов большинства известных химических элементов;
во-вторых, появилось четкое понятие о группах сходных по химическим свойствам элементов (естественных группах);
в-третьих, к 1869 г. была изучена химия многих редких элементов, без знания которой трудно было бы прийти к какому-либо обобщению.
Наконец, решающий шаг к открытию закона заключался в том, что Менделеев сопоставил между собой все элементы по величине атомных весов. Предшественники же Менделеева сравнивали элементы, сходные между собой, т. е. элементы естественных групп. Эти группы оказывались не связанными. Менделеев логично объединил их в структуре своей таблицы.
Как же был открыт периодический закон?
Иногда среди историков науки вспыхивает спор: что раньше родилось в сознании Менделеева — периодический закон или периодическая система элементов?
По нашему мнению, этот спор беспредметен. Система элементов — это закономерность, выраженная в виде таблицы. Но чтобы уловить смысл закона, нужно было прежде всего свести все известные химические элементы в определенную систему, т. е. в таблицу. Поэтому никак нельзя разрывать систему и закон.
Вот как сам Менделеев охарактеризовал течение творческого процесса, который представляет собой открытие периодического закона: «…невольно зародилась мысль о том, что между массой и химическими свойствами необходимо должна быть связь. А так как масса вещества, хотя и не абсолютная, а лишь относительная, выражается окончательно в виде весов атомов, то надо искать функциональное соответствие между индивидуальными свойствами элементов и их атомными весами. Искать же что-либо, хотя бы грибы или какую-нибудь зависимость, нельзя иначе, как смотря и пробуя. Вот я и стал подбирать, написав на отдельных карточках элементы с их атомными весами и коренными свойствами, сходные элементы и близкие атомные веса, что быстро и привело к тому заключению, что свойства элементов стоят в периодической зависимости от их атомного веса, причем, сомневаясь во многих неясностях, я ни минуты не сомневался в общности сделанного вывода, так как случайность допустить было невозможно».
Казалось бы, всё обстояло довольно просто. И в самом деле нет ничего особенного в том, чтобы, написав на карточках символы элементов, их атомные веса и важнейшие (коренные) свойства, расположить их по порядку. Как именно? Самый очевидный способ – расположить все элементы в ряд по возрастанию атомных весов, начиная с самого лёгкого – водорода. Подметить же закономерность в изменении свойств правильно расположенных элементов, должно быть, не так уж трудно. Ведь эти свойства во времена Менделеева были более или менее хорошо известны.
В чём же заслуга Менделеева? Давайте условимся на некоторое время забыть всё, что вам уже известно о химии, всё, что вы успели узнать в школе о периодической системе, вообразим, что вы перенеслись в середину XIX века и можете знать только то, что знали современники Менделеева. Попытаться проникнуть в творческую лабораторию ученого, разобраться в том, как его мысль постепенно подходила к открытию, — дело чрезвычайно трудное, а иногда и вовсе не возможное. Нам, однако, повезло: на помощь пришел сам Менделеев, рассказавший, что он начал с комбинирования карточек. Вот мы и попробуем шаг за шагом пройти по пути, которым шел великий ученый. Не ручаемся за точность картины, но дело обстояло примерно так…


«Первые мысли о периодичности, — писал Д.И. Менделеев, — вложены мною в листок, который 1 марта 1869 г. был послан мною многим ученым».
Это самая первая таблица периодической системы элементов. Замечательно то, что в ней уже были оставлены и отмечены знаком вопроса пустые места.
Посмотрим, в какой последовательности располагались элементы по величине их атомных весов.
Наименьший атомный вес у водорода (Н), он равен 1. Следующий по порядку был в то время литий (Li). Его атомный вес около 7. А вот какой элемент должен быть следующим — на сей счет единого мнения не существовало. Дело в том, что точно не была известна формула окиси бериллия. Одни ученые считали, что она записывается как ВеО, другие — как Ве2О3. Но в первом случае атомный вес бериллия должен был равняться (округлённо) 9, а во втором — 14. Поэтому место элемента в ряду оказывалось неопределённым. Если оставить пока Ве в покое, то дальнейшее расположение элементов должно быть таким:
В(11) С(12) N(14) O(16) F(19) Na(23) Mg(24) Al(27) Si(28) P(31) S(32) Cl(35)
Атомные веса здесь округлены до целых чисел.
А как расположил Менделеев свои карточки с элементами? Конечно, на первой карточке у Менделеева также было написано название, атомный вес и свойства водорода.
Вторую карточку с атомным весом и свойствами металла лития он поместил под карточкой водорода. На третье место рядом с литием Менделеев положил карточку, на которой было написано: Ве(9), а не Ве(14).
И это был смелый шаг, потому что из нескольких значений атомных весов бериллия Менделеев выбрал одно, вполне определенное. Почему он сделал именно так? Да потому, что он принял во внимание особенности химических свойств бериллия: они представляли плавный переход от свойств лития к свойствам бора.
Карточку бора Менделеев поместил на четвертое место. Пятое место занял углерод. На шестом месте — азот, далее следовали кислород и фтор. Девятая карточка, принадлежащая металлу натрию, была помещена под второй, на которой были написаны химические характеристики металла лития.
По порядку следующее место занял магний, за ним — алюминий. Под углеродом оказался кремний, под кислородом — сера, под фтором — хлор.
Вот так Менделеев расположил свои карточки с названиями и свойствами элементов в начале своей таблицы:

Итак, в вертикальных рядах оказались химически сходные элементы. Металл литий похож на металл натрий: оба мягкие, легкие, режутся ножом, бурно реагируют с водой, образуя щелочи. Бериллий и магний схожи друг с другом. У фтора много общего с хлором — они образуют с металлами очень похожие соединения. И каждый химик знает, что свойства кислорода и серы сходны между собой.
При таком расположении совершенно четко проявилась периодичность свойств у элементов. В двух первых коротких периодах менделеевской таблицы правильно чередуются элементы с аналогичными свойствами.
Как же все-таки эти периоды были построены Менделеевым?
Пожалуй, он был не совсем прав, когда утверждал, что расположил элементы по их атомному весу.
Если бы ученый действительно расположил их по возрастанию тех атомных весов, которые были известны науке в то время, то никакого периодического закона обнаружить было бы невозможно даже в первых рядах таблицы. Скорее наоборот, Менделеев установил на основании периодического закона правильный атомный вес бериллия.
Позднейшие исследования подтвердили это предсказание.
Если исходить из атомных весов, известных в середине XIX в., то продолжение ряда элементов идущих за хлором, надо было бы построить так:

Тайна пустого места
Но, продолжая построение своей таблицы, Менделеев разместил карточки совсем не так. Под карточкой натрия была помещена карточка с очень похожим на натрий калием, и калий стал началом нового ряда. Под магнием оказался сходный с ним кальций.
Следующим в порядке возрастания атомного веса должен был бы идти ванадий, но его карточка пока отложена в сторону, а вместо неё рядом с кальцием Менделеев кладет пустую (!) карточку. С точки зрения химика того времени это непонятный и ничем не оправданный поступок.
Можно было ждать, что вслед за пустой карточкой будет положена карточка ванадия. Но вместо ванадия на следующем месте оказывается титан, у которого Менделеев осмеливается, не проводя сам никаких исследований, вопреки всему, что известно о титане всем химикам во всем мире, изменить его атомный вес с 52 на 48 (!). После чего, наконец, за титаном следует карточка ванадия, и только за ней идут карточки хрома и марганца.
Как же все-таки располагал свои карточки Менделеев? Ведь и в этом ряду таблицы он разместил элементы вопреки возрастанию известных в то время атомных весов.
Прежде чем поместить карточку титана в таблицу, Менделеев, по существу, предсказал истинное значение его атомного веса, так же как это он сделал и для бериллия.
Этот период в таблице Менделеева длинный. За марганцем идут железо (Fе) — 56, кобальт (Со) — 59, никель (Ni) — 59, далее медь (Сu) — 63, цинк (Zn) — 65. Но вслед за цинком ученый снова оставил в своей таблице подряд два пустых места.
Далее следовали карточки с хорошо известными элементами — мышьяком, селеном и бромом, завершающим длинный период. При этом карточки мышьяка, селена и брома оказались лежащими под карточками сходных с ними элементов конца предыдущего короткого периода, т. е. элементов фосфора, серы и хлора.

Из того, что мы разобрали, совершенно очевидно, что всё обстояло далеко не так просто, как рассказывал об этом сам Менделеев. Одних только фактов, которые были известны химикам до Менделеева, как бы их ни комбинировать, было недостаточно, чтобы открыть один из величайших законов природы — периодический закон.
Если расположить элементы, известные к 1869 г., по возрастанию значений их атомных весов, не исправляя, казалось бы произвольно, атомных весов у отдельных элементов и не оставляя пустых мест, то обнаружить существование периодической закономерности было бы очень трудно.
Нужно было не только знать накопленный в течение многих веков химический опыт. Нужно было обладать тонкой интуицией, а также научной смелостью, чтобы, осознав периодическую закономерность, исправлять старое и предсказывать новое.
Великое предсказание
Что же означают пустые места в таблице Менделеева?
Может быть, это пробелы в природе, и потому химики не нашли элементы для пустых клеток таблицы? Или это пробелы в человеческом знании о природе? Существует ли, например, в природе элемент, атомный вес которого больше, чем у кальция, и меньше, чем у титана, и в то же время похожий химическими свойствами на бор и алюминий?
У Менделеева сомнений не было. Каждое место и таблице соответствует определенному химическому элементу, который должен обязательно существовать.
Места, на которых были расположены карточки с названиями элементов, клетки в периодической таблице, где вписаны символы элементов и их атомные веса, для учёного были полны глубочайшего содержания: они определяли природу каждого элемента, его физические и химические свойства и свойства его соединений.
В 1871 г. в журнале Русского химического общества появилась большая статья Менделеева. Она называлась «Естественная система элементов и применение её к указанию свойств неоткрытых элементов». Вряд ли в мировой научной литературе когда-либо была опубликована статья, похожая на эту! В ней Менделеев описал три никем и никогда в мире не виданных химических элемента, причём описал так обстоятельно, как не смог бы это сделать иной исследователь, державший в руках их соединения и посвятивший долгие годы изучению их в лаборатории.
«Решаюсь сделать это ради того, чтобы хотя со временем, когда будет открыто одно из этих предсказываемых мною тел, иметь возможность окончательно увериться самому и уверить других химиков в справедливости тех предложений, которые лежат в основании предполагаемой мною системы»,- писал в этой статье Менделеев.
Каким же путем периодический закон дает возможность описывать неведомое? Каким образом место в таблице определяет свойства элемента? Лучше всего это можно понять, если попытаться, по примеру Менделеева, сравнить свойства элемента пустой клетки со свойствами его соседей. Выделим из таблицы ту часть, которая включает пустые места и окружающие их элементы.
Пустая клетка между кальцием и титаном находится в начале четвёртого периода. А две пустые клетки, расположенные рядом между цинком (Zn) и мышьяком (As), находятся в конце этого периода.
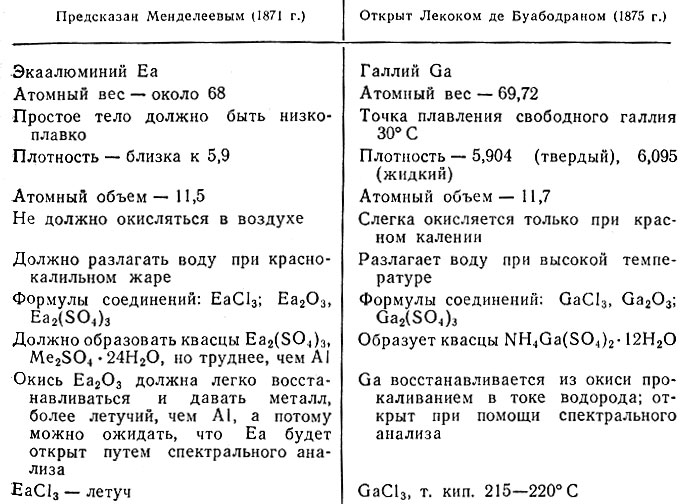
Гипотетический (предполагаемый) элемент, который должен был заменять первое пустое место, Менделеев назвал экаборм. В таблице он следует за кальцием. Тот элемент, который должен занять пустое место около цинка, Менделеев назвал экаалюминием, а соседний с ним – экасилицием.
Пустое место экабора находится между кальцием (атомный вес 40) и титаном (атомный вес 48). Следовательно, атомный вес экабора должен быть близким к среднему значению 44.
С кислородом он должен давать окись, аналогичную по формуле окисям бора и алюминия: Х2О3. Экабор должен быть легким металлом: ведь он стоит между двумя легкими металлами — кальцием и титаном. Относительная плотность соседей экабора по ряду позволяет определить и его относительную плотность. Для кальция она равна 1.5, для титана 4.5. Поэтому относительная плотность экабора должна быть приблизительно равна 3.
У экабора должны быть бесцветные соли, потому что соседи образуют бесцветные соединения. Металл не летуч, так как не летучи его соседи. Основные свойства его будут слабыми, поскольку основные свойства окиси титана слабы. Вот таким путем и можно предсказать химические свойства нового, и никем не известного и никем не виданного элемента.
Попробуем описать и еще один элемент, пустое место которого находится рядом с цинком,- экаалюминий.
Между цинком и мышьяком Менделеев оставил два пустых места. Атомный вес мышьяка — 75, цинка — 65. Нетрудно сообразить, что экаалюминий должен обладать атомным весом около 70. Он помещается в третьем столбце рядом с металлом цинком; в этом столбце находится алюминий — тоже металл; и экаалюминий должен быть на него похожим. Значит, экаалюминий будет тоже металлом.
Плотность его мы определили бы по известной плотности ближайших соседей, учитывая лишь, что рядом с экаалюминием есть еще одно пустое место — экасилиций. Относительная плотность экаалюминия должна быть близка к 6.
Соединения алюминия с хлором обладают при высокой температуре летучестью, и хлористое соединение экаалюминия должно быть также летучим.
Вот такими словами Менделеев заканчивает описание свойств экаалюминия: «Можно надеяться, что он будет открыт спектральным исследованием, подобно тому как открыты следующие за ним индий и таллий…».
Таким образом, Д.И. Менделеев не только описал неведомое, но и предсказал, как оно будет познано.
Краткая хроника важнейших событий после открытия Великого закона
Вот как развивались события в течение двух с половиной лет после открытия закона:
В сентябре 1869 г. Д.И. Менделеев показал, что атомные объёмы простых веществ находятся в периодической зависимости от атомных весов, а в октябре обнаружил такую же зависимость для высшей валентности элементов в солеобразующих окислах.
Летом 1870 г. Менделеев счёл необходимым изменить неправильно определённые атомные веса индия, церия, иттрия, тория и урана и в связи с этим изменил размещение этих элементов в периодической системе. Так, уран оказался самым последним элементом в естественном ряду, самым тяжелым по величине атомного веса.
11 декабря 1870 г. Менделеев закончил статью «Естественная система элементов и применение её к указанию свойств некоторых элементов». Он впервые назвал свою систему естественной и впервые же употребил понятие «закон периодичности». В апреле 1871 г. Менделеев впервые назвал систему периодической: «… было бы правильнее назвать мою систему периодической, потому что она вытекает из периодического закона…». В июле 1871 г. Менделеев завершил работу над своей главной статьёй, посвящённой Великому закону. Она называлась «Периодическая законность химических элементов». Спустя много лет Менделеев так охарактеризовал её: «Это лучший свод моих взглядов и соображений о периодичности элементов…».
Здесь Менделеев впервые привёл каноническую формулировку периодического закона, просуществовавшую до его физического обоснования: «Свойства элементов, а потому и свойства образуемых им простых и сложных тел, стоят в периодической зависимости от их атомного веса».
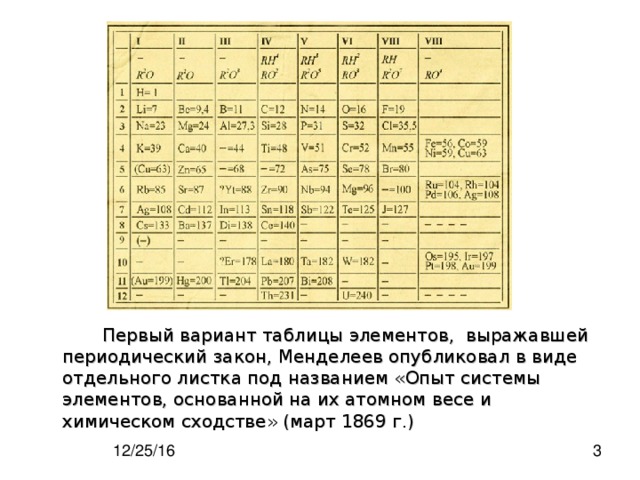

Естественная система элементов Д.Э. Менделеева (1871 г.)
Эта таблица была помещена Менделеевым в одном из первых изданий его учебника «Основы химии» (1871 г.). В ней ещё очень много пустых мест. Ещё не открыты геллий, скандий и германий; отсутствует нулевая группа.
В таблице оставлены места для неоткрытых аналогов марганца, йода, теллура, цезия, бария, тантала. Много прочерков соответствует предполагаемым редкоземельным элементам (между барием и танталом).
Большинство предсказанных Менделеевым элементов было обнаружено в действительности. Обратите внимание, как много общего у этой таблицы с современным изображением периодической системы.
Как оправдались предсказания Менделеева
Не прошло и шести лет, как весь мир облетело известие: в 1875 г. молодой французский ученый-спектроскопист П. Лекок де Буабодран выделил из минерала, добытого в Пиренейских горах, новый элемент. Буабодрана навела на след слабая фиолетовая линия в спектре минерала, которую нельзя было приписать ни одному из известных химических элементов. В честь своей родины, которая в древности называлась Галлией, Буабодран назвал новый элемент галлием. Галлий — очень редкий металл, Буабодрану стоило большого труда добыть его в количестве немногим больше булавочной головки. Но Буабодран оказался большим искусником. Он ухитрился с этой крупинкой проделать много интересных опытов и подробно описал плотность галлия, температуру плавления, соединение с кислородом, и даже соли.
Каково же было удивление Буабодрана, когд через Парижскую академию наук он получил письмо с русской маркой, в котором сообщалось: в описании свойств галлия всё верно, за исключением плотности: галлий тяжелее воды не в 4.7 раза, как утверждал Буабодран, а в 5.9 раза.
Неужели кто-то другой открыл галлий раньше? Буабодран заново определил плотность галлия, подвергнув металл более тщательной очистке. И оказалось, что он ошибся, а автор письма — это был, конечно, Менделеев, который и не видел галлия, — прав: относительная плотность галлия не 4.7 а 5.9.
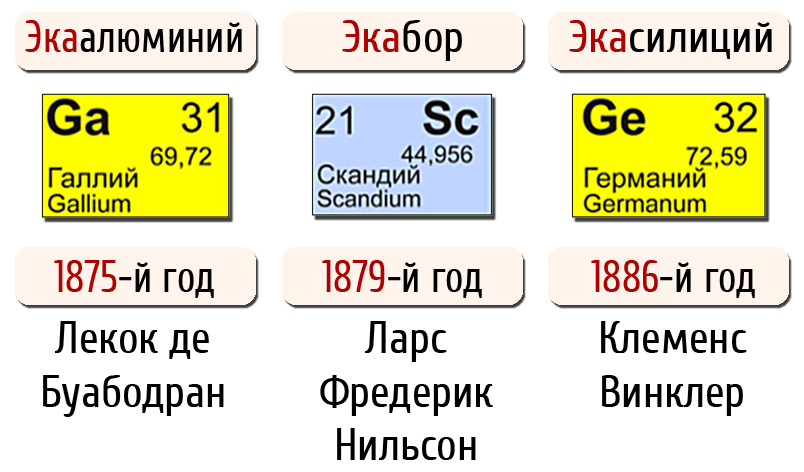
Ещё через четыре года, в 1879 г. шведский химик Л. Нильсон нашел новый элемент в редком минерале гадолините. Его назвали скандием. Когда же были изучены его свойства, стало совершенно очевидно, что это не что иное, как давно известный, по предсказаниям Менделеева, экабор.
А через 16 лет после предсказания Менделеева немецкий химик К. Винклер открыл новый элемент (1886 г.) и назвал его германием.
На этот раз Менделееву не пришлось самому указывать, что и этот вновь открытый элемент был им предсказан ранее. Винклер отметил, что германий полностью соответствует экасилицию Менделеева. Винклер писал в своей работе: «Едва ли можно найти иное более поразительное доказательство справедливости учения о периодичности, как во вновь открытом элементе. Это не просто подтверждение смелой теории, здесь мы видим очевидное расширение химического кругозора, мощный шаг в области познания».
Винклер не искал германия по приметам, опубликованным Менделеевым. Он наткнулся на него случайно. Получалось так, что еще не открытые химические элементы как бы взяты на учет: их столько, сколько пустующих клеток в периодической таблице Менделеева. Приметы каждого из них более или менее известны. И даже можно предсказать заранее, в каких минералах нужно их искать, какими химическими способами следует извлекать эти элементы из минералов, в которых они скрываются.
Существование в природе более десяти новых, не известных никому элементов предсказал сам Менделеев. Для десятка элементов он предсказал правильные атомные веса. Все последующие поиски новых элементов в природе велись исследователями при помощи периодического закона и периодической системы. Они не только помогали ученым в поисках истины, но и способствовали исправлению ошибок и заблуждений в науке.
Блестяще оправдались предсказания Менделеева — открыты три новых элемента: галлий, скандий, германий. Разрешилась долго мучившая ученых загадка бериллия. Атомный вес его был наконец точно определен, и место элемента рядом с литием подтвердилось раз и навсегда. К 90-м годам XIX века, по словам Менделеева, «периодическая законность упрочилась». В учебники по химии в разных странах уже без сомнений стали включать менделеевскую периодическую систему.
Великое открытие получило всеобщее признание!
Периодические закономерности изменения свойств элементов по периодам и группам
Заряд ядра – главная характеристика химического элемента.
Валентные электроны – электроны, расположенные на внешнем энергетическом уровне. От них зависит реакционная способность (к образованию связей с другими атомами).
Металличность (металлические свойства) – способность атомов элемента отдавать электроны.
Неметалличность (неметаллические свойства) – способность атомов элементов присоединять электроны.
Радиус атома – расстояние от ядра атома до электрона, находящегося на последнем уровне.
Энергия ионизации атома (I) – количество энергии, которое необходимо для отрыва электрона от атома элемента, т.е. превращение атома в положительно заряженный ион:
Э0 + I Э+ + e
Чем меньше энергия ионизации, тем легче атом отдает электрон, тем сильнее металлические свойства элемента.
Сродство к электрону (Eср) – энергия, которая выделяется при присоединении электрона к нейтральному атому, т.е. при превращении атома в отрицательно заряженный ион:
Э0 + е Э- + Eср
Чем больше сродство к электрону, тем легче атом присоединяет электрон, тем сильнее выражены неметаллические свойства.
Универсальная характеристика металличности и неметалличности элементов – электроотрицательность.
Электроотрицательность элемента – способность его атомов притягивать к себе электроны, которые участвуют в образовании связей с другими атомами в молекуле.
При определении значений относительной электроотрицательности различных элементов за единицу принята электроотрицательность лития.
Периодический закон (Д.И. Менделеев, 1868 г.):
«Свойства элементов, а также свойства и формы соединений находятся в периодической зависимости от величины их относительных атомных масс».
Современная формулировка Периодического закона:
«Свойства элементов, а также свойства и формы соединений находятся в периодической зависимости от величины заряда ядер атомов».
Физический смысл Периодического закона:
- периодическое изменение свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и электронных структур.
| Характеристика изменений | В периодах
| В |
| Число ЭУ | Постоянно | Возрастает |
| Число ВЭ | От 1 до 8 | Постоянно |
| Радиус атома | Убывает | Возрастает |
| Электроотрицательность | Возрастает | Убывает |
| Металличность | Убывает | Возрастает |
| Неметалличность | Возрастает | Убывает |
Вопросы для контроля
Кто и когда открыл периодический закон?
В каком порядке расположил Д.И. Менделеев все известные элементы?
Какое изменение свойств элементов наблюдается при увеличении их атомной массы?
Как сформулировал Д.И. Менделеев периодический закон?
Что является графическим выражением периодического закона?
Сколько периодов и сколько групп в периодической системе?
Что такое период? Какие периоды являются малыми и какие большими?
Сколько элементов в каждом периоде?
Что такое группа? Из каких подгрупп состоит каждая группа периодической системы?
В каком периоде, в какой группе и в какой подгруппе находятся элементы с порядковыми номерами 15, 28, 53, 59, 75?
Какие частицы входят в состав атома?
Чему равен положительный заряд ядра атома?
Почему число протонов в ядре равно числу электронов в атоме?
Чему равны относительные массы: а) электрона; б) протона, в) нейтрона?
Во сколько раз масса протона больше массы электрона?
Почему масса атома почти равна массе ядра?
Что называют массовым числом атома?
Как устроено атомное ядро? Что такое изотопы?
Чем отличаются атомы изотопов одного элемента?
Как называются изотопы водорода? Каков состав ядер этих изотопов?
Чему равен заряд ядра и число электронов в атомах следующих элементов: бор (В), селен (Se), кислород (O), хлор (Cl), калий (K), алюминий (Al), барий (Ba)?
Назовите элемент, в ядре атома которого содержится 9 протонов?
Назовите элемент, в атоме которого содержится 28 электронов.
Чему равно число нейтронов в атомах следующих изотопов: 18O, 130I, 40K, 13C?
Что такое электронная оболочка атома?
Каков характер движения электрона в атоме?
Что называют атомной орбиталью?
Что такое электронное облако?
Что характеризует главное квантовое число?
Какие значения принимает главное квантовое число?
Что такое энергетический уровень?
Что характеризует побочное квантовое число?
Какие значения принимает побочное квантовое число?
Как называется и какую форму имеют орбитали с l=0?
Как называются и какую форму имеют орбитали с l=1?
Что такое энергетический подуровень?
Что характеризует магнитное квантовое число квантовое число?
Из какого числа орбиталей состоят s-, p-, d-, f-подуровни?
Что характеризует спиновое квантовое число и какие значения оно принимает?
Как формулируется принцип Паули?
Какие электроны называется спаренными?
Какие спины имеют спаренные электроны?
Чему равно максимальное число электронов на энергетическом уровне?
Как формулируется принцип наименьшей энергии?
Почему принцип наименьшей энергии определяет порядок заполнения энергетических подуровней?
Дайте формулировку правила Гунда?
Что показывают электронные формулы атомов?
Что показывают электронно-графические формулы атомов?
Сколько электронных слоев в атомах элементов четвертого периода?
Чему равны все квантовые числа для двух электронов, которые находятся на 4s-подуровне?
На каком энергетическом уровне и на каком энергетическом подуровне находится электрон, для которого n=3, l=0? Какую форму имеет облако этого электрона?
Сколько электронов находится на внешнем энергетическом уровне в атомах элементов Ca и S?
Найдите в периодической системе пары элементов, расположенных в нарушение увеличения относительной атомной массы. Можно ли поменять их местами, чтобы не нарушать возрастание относительной атомной массы? Почему?
Открытие благородных газов, сделанное после формулировки периодического закона, не смогло нарушить теорию периодичности. Почему? Охарактеризуйте положение в периодической системе благородных газов.
Почему заряд ядра является главной характеристикой элемента?
Что такое металличность элементов? Что является количественной характеристикой металличности?
Что такое неметалличность элементов? Что является количественной характеристикой неметалличности?
Что характеризует электроотрицательность?
Почему d-элементы одного периода похожи по свойствам? Почему все d-элементы являются металлами?
Какие электроны называются валентными электронами?
Почему высшая валентность элементов изменяется периодически?
Дайте современную формулировку периодического закона?
В чем заключается физический смысл периодического закона?
Какое значение имеют периодический закон и периодическая система элементов Д.И. Менделеева?
По положению элементов в периодической системе определите, какой элемент имеет большую ЭО, больший радиус атома: а) бром или хлор, б) магний или кальций, в) кальций и алюминий, г) фтор или азот.
Сколько валентных электронов в атомах следующих элементов: бериллия, бора, кремния, фосфора, серы?
Какой из двух элементов обладает более выраженными металлическими свойствами: а) фтор или хлор, б) калий или натрий, б) бор или углерод, в) фосфор или азот, г) сера или мышьяк?
Задания для самостоятельной работы
Напишите символ, название и порядковый номер элемент, который находится: а) в четвертом периоде и в главной подгруппе шестой группы; б) в третьем периоде и в главной подгруппе пятой группы, в) в пятом периоде и в побочной подгруппе второй группы, г) в четвертом периоде и в побочной подгруппе четвертой группы.
Напишите символы, названия и порядковые номера всех элементов, которые находятся: а) в побочной подгруппе пятой группы, б) в главной подгруппе первой группы.
Какие элементы главной подгруппы четвертой группы являются элементы малых периодов? Напишите их символы, названия, порядковые номера.
Напишите символы изотопов фосфора, атомы которых содержат 31, 32, 33 нейтрона.
Определите молекулярную массу воды, молекулы которой содержат тяжелый изотоп кислорода – тритий.
Элемент медь существует в виде двух изотопов: 63Cu и 65Cu. Содержание в природе первого изотопа равно 73%, второго – 27 %. Вычислите относительную атомную массу меди.
Напишите наборы всех четырех квантовых чисел для электронов, которые находятся на 3p-подуровне:
| ↑ | ↑ | ↑ |
Заполните таблицу:
| n | l | обозначение подуровней |
| 4 | 1 |
|
| 3 | 0 |
|
| 6 | 3 |
|
| 4 | 2 |
|
Используйте правило Гунда и напишите электронно-графические формулы электронных конфигураций p3, d4, f8.
Постройте схему строения, электронную и электронно-графическую формулы атомов:а) Be, Al, Ti, Cl, б) B, Si, V, Ne, в) N, Na, Sc, Ar, г) C, S, Mn, Ca.
Расположите элементы в порядке возрастания металлических свойств, электроотрицательности, числа энергетических уровней (если порядок определяется) а) S, Cl, Na, Al, Si, б) Ca, Hg, Ba, Sr, Be.
Расположите элементы в порядке уменьшения неметаллических свойств, радиуса атома, числа валентных электронов (если порядок определяется) а) N, B, C, Li, F, б) Se, Te, O, S, Po.
Список использованной литературы
Волков, А.И. Химия: школьный курс в кратком изложении / А.И. Волков, И.И. Курило. – Минск: Литера Гранд; Книжный дом, 2016. – 224 с.
Габриелян, О.С. Химия для профессий и специальностей технического профиля: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М.: Академия, 2017. – 272 с.
Егоров, А.С. Химия: пособие-репетитор для поступающих в вузы / А.С. Егоров, К.П. Шацкая, Н.М. Иванченко и др. – Ростов н/Д.: Феникс, 2003. – 768с.
Ерохин, Ю.М. Химия: учеб. для студ.учреждений сред. проф. образования / Ю.М. Ерохин. – М.: Академия, 2014. – 400 с.
Трифонов, Д.Н. Великий закон. Библиотечка Детской энциклопедии «Ученые – школьнику» / Д.Н. Трифонов, И.В. Петрянов. – М.: Педагогика, 1984. – 128 с.
28
 Получите свидетельство
Получите свидетельство Вход
Вход




 главных подгруппах
главных подгруппах 








 Лекция. Периодический закон и Периодическая система химических элементов Д.И. Менделеева, строение атома (2.48 MB)
Лекция. Периодический закон и Периодическая система химических элементов Д.И. Менделеева, строение атома (2.48 MB)
 0
0 44
44 0
0 Нравится
0
Нравится
0


