МОУ СШ №1 р.п Новоспасское
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ПО ХИМИИ
Учитель химии - Михайлова Лилия Алексеевна
Высшей квалификационной категории
2023г.
Введение
Лабораторные опыты по химии проводятся в специально оборудованном химическом кабинете.
Химия, как и любая экспериментальная наука, предъявляет к себе определенные требования. Поскольку безопасная работа в химической лаборатории и для себя, и для окружающих является основой проведения и успеха эксперимента, необходимо строго соблюдать правила организации работы и техники безопасности.
Наиболее вероятными источниками несчастных случаев являются: неумелое обращение с химическими веществами (отравление, химические ожоги, пожары, взрывы, аллергии), с лабораторными приборами (поражение электрическим током, термические ожоги и травмы), а также со стеклянными приборами и посудой (порезы и т.д.). Только строгое соблюдение правил работы и мер безопасности, соблюдение учебной дисциплины позволяют полностью исключить возможность несчастных случаев в лаборатории.
Допуск в лабораторному практикуму разрешается только после знакомства с инструкцией по технике безопасности, вводного инструктажа.
При работе в химическом кабинете необходимо придерживаться следующих правил:
Работы проводить аккуратно, соблюдать тишину.
Предварительно повторить теоретический материал соответствующей главы (параграфа) и ознакомиться с содержанием практической работы.
Проверить наличие необходимого оборудования и реактивов для данной работы.
Уяснить и точно соблюдать порядок и последовательность операций, указанных в тексте практической работы.
Соблюдать все меры предосторожности, указанные в инструкции или сообщенные предварительно устно.
Внимательно следить за ходом опыта. В случае неудачной постановки опыта, прежде чем его повторить, следует установить причину; в сомнительных случаях обращаться к учителю.
Все записи наблюдений делать сразу же после окончания опыта в тетради для практических работ.
После окончания работы вымыть использованную посуду и привести рабочее место в порядок.
Сдать реактивы учителю.
Отчет о лабораторном опыте должен содержать следующие сведения:
Номер работы.
Название работы.
Цель работы, оборудование и реактивы.
Краткое описание хода работы с указанием условий проведения опыта.
Наблюдения и уравнения протекающих реакций.
Выводы.
Перечень
лабораторных опытов по курсу химии 8 класс
| № п/р | Название лабораторного опыта
|
| 1 | Рассмотрение веществ с различными физическими свойствами.
|
| 2 | Разделение смеси с помощью магнита.
|
| 3 | Примеры физических и химических явлений.
|
| 4 | Ознакомление с образцами простых (металлы и неметаллы) и сложных веществ, минералов, горных пород |
| 5 | Разложение основного карбоната меди.
|
| 6 | Реакция замещения меди железом.
|
| 7 | Ознакомление с образцами оксидов.
|
| 8 | Взаимодействие водорода с оксидом меди (2).
|
| 9 | Взаимодействие основных оксидов с кислотами.
|
| 10 | Получение осадков нерастворимых гидроксидов и изучение их свойств.
|
Лабораторный опыт №1.
«Рассмотрение веществ с различными физическими свойствами».
Цель: Изучить некоторые физические свойства веществ, проанализировать полученные экспериментальные данные, найти различия в свойствах веществ.
Оборудование и реактивы: образцы веществ – медь (проволока), сера, вода, нашатырный спирт, поваренная соль, мел.
Задание 1.
В каком агрегатном состоянии находятся выданные вам вещества?
Какого они цвета?
Ознакомьтесь с запахом жидкостей (соблюдая ТБ).
Определите, растворяются ли данные вещества в воде (положить небольшую порцию вещества в пробирку и прилить воды, перемешать раствор стеклянной палочкой, стараясь не задевать стенок и дна).
Наблюдения занести в таблицу:
| Вещества | Агрегатное состояние | Цвет
| Запах
| Растворимость в воде |
| Медь |
|
|
|
|
| Сера |
|
|
|
|
| Вода |
|
|
| - |
| Нашатырный спирт |
|
|
| - |
| Поваренная соль |
|
|
|
|
| Мел |
|
|
|
|
Задание 2.
Сравните свойства некоторых веществ друг с другом. Выделите сходства и различия.
Сделайте общий вывод.
Лабораторный опыт № 2
«Разделение смеси с помощью магнита».
Цель: изучить практическое применение способов разделения смеси для очистки веществ от примесей. Рассмотреть способ разделения сухой смеси с помощью магнита.
Оборудование: образец загрязненных песком железных опилок, лист белой бумаги, магнит.
Задание 1. На один листочек бумаги насыпьте немного порошкообразной серы, на другой – столько же порошкообразного железа.
Отметьте цвет этих веществ.
Проверьте действие магнита на порошок серы и на порошок железа.
Задание 2. Приготовьте смесь порошков серы и железа. Образец смеси высыпать на белый лист бумаги. Основываясь на свойствах магнита разделить смесь.
Сделайте вывод.
Лабораторный опыт №3
«Примеры физических и химических явлений».
Цель: научить определять, какие явления относятся к физически, а какие к химическим, изучить признаки химических реакций.
Оборудование и реактивы: пробирки, спиртовка, спички, газоотводная трубка, фарфоровая чашечка, восковая свеча, мрамор, соляная кислота, известковая вода, хлорид калия, медная проволока, сульфат меди, гидроксид натрия.
Опыт 1. В пробирку налить воды и нагреть ее до кипения. В момент кипения воды, появления пара подержать стеклянную пластинку над отверстием пробирки. Что вы наблюдаете? Эта реакция является химической или физической?
Опыт 2. В пробирку поместить кусочек мрамора (мела) и прилить соляной кислоты. Что вы наблюдаете? Эта реакция является химической или физической?
Опыт 3. Полученный в опыте 2 газ пропустите через известковую воду. Что вы наблюдаете? Эта реакция является химической или физической?
Опыт 4. Возьмите раствор хлорида калия. Вылейте раствор в фарфоровую чашечку и проведите выпаривание. Что вы наблюдаете? Эта реакция является химической или физической?
Опыт 5. В пламени спиртовки прокалите стеклянную трубочку до размягчения стекла и согните ее. Что вы наблюдаете? Эта реакция является химической или физической?
Опыт 6. В пламя спиртовки внесите свечку. Что вы наблюдаете? Эта реакция является химической или физической?
Опыт 7. К раствору сульфата меди прилейте раствор гидроксида натрия. Что вы наблюдаете? Эта реакция является химической или физической?
Лабораторный опыт №4
«Ознакомление с образцами простых (металлы и неметаллы) и сложных веществ, минералов, горных пород».
Цель: ознакомиться с образцами простых и сложных веществ, минералами и горными породами, научиться их классифицировать.
Оборудование и реактивы: коллекция «Металлы», магнит, поваренная соль, сахар, алюминий, цинк, железо, медь, сера, оксид меди, гранит, кварц, песок, глина, полевой шпат, известняк.
Задание 1. Даны вещества: поваренная соль, сахар, алюминий, цинк, железо, медь, сера, оксид меди. Найдите формулы этих веществ. Какие из этих веществ являются простыми веществами, а какие сложными? Выпишите, сделайте вывод.
Задание 2. Определите, какие из выданных вам в задании 1 простых веществ являются металлами? На основании чего вы смогли сделать свой выбор. Сделайте вывод.
Задание 3. Рассмотрите выданные вам образцы: гранит, кварц, песок, глина, полевой шпат, известняк. Определите какие из выданных веществ являются минералами, а какие горными породами. Сделайте вывод.
*Минерал — это продукт природного процесса, имеющий определенные физические свойства и химический состав. Минерал имеет кристаллическую структуру.
Горная порода — природное соединение одного или нескольких минералов, они сложены из частичек минералов.
Лабораторный опыт №5
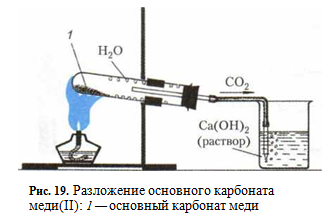
«Разложение основного карбоната меди».
Цель: Изучить пример реакции разложения
Оборудование и реактивы: пробирка лабораторная 2 шт, трубка газоотводная полимерная, стакан, лабораторный штатив с лапкой, спиртовка, спички. раствор гидроксида кальция (известковая вода) Ca(OH)2, основной карбонат меди(II) (малахит) CuCO3∙Cu(OH)2.
Опыт. Поместите немного порошка основного карбоната меди (И) в пробирку и закройте ее пробкой с газоотводной трубкой.
Проверьте герметичность собранного прибора. Для этого конец газоотводной трубки опустите в стакан с водой не глубже чем на 1 см, а пробирку зажмите в руке. Если при этом в воду выделяются пузырьки воздуха, то прибор собран герметично. Если пузырьки воздуха не выделяются, то необходимо проверить, прочно ли соединены отдельные детали прибора.
Закрепите пробирку в штативе так, как показано на рисунке (донышко пробирки должно быть немного выше, чем ее отверстие).
Конец газоотводной трубки опустите в стакан с известковой водой. Сначала обогрейте в пламени всю пробирку, а затем нагрейте ее в том месте, где находится порошок. Цвет порошка из зеленого становится черным, на стенках пробирки появляются капельки воды, известковая вода мутнеет.
Задание 1. Сравните свойства образовавшегося черного порошка с веществом, которое получилось при прокаливании медной пластинки, и сделайте вывод.
Задание 2. Какой газ выделился при опыте? Обоснуйте свой ответ.
Задание 3. Почему при нагревании основного карбоната меди(II) пробирку надо держать в наклонном положении?
Сделайте общий вывод.
Лабораторный опыт №6
«Реакция замещения меди железом».
Цель: сформировать представления о химических реакциях, научить осуществлять реакции замещения, описывать наблюдения, делать правильные выводы.
Оборудование и реактивы: пробирки, растворы хлорида и сульфата меди (2), железные гвозди или канцелярские кнопки
Опыт. В одну пробирку наливаем раствор сульфата меди (2), во вторую пробирку раствор хлорида меди (2). В каждую из пробирок помещаем железный гвоздь или канцелярскую кнопку. Что вы наблюдаете? Какие вещества образовались в результате химической реакции в каждой из пробирок? Составьте уравнения соответствующих реакций. Сделайте вывод.
Лабораторный опыт №7
«Ознакомление с образцами оксидов».
Цель: знакомство с физическими и химическими свойствами оксидов.
Даны образцы различных оксидов. Начертите в своих тетрадях таблицу и заполните ее.
| Название оксида | Физические свойства | ||
|
| Агрегатное состояние | Цвет | Запах |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лабораторный опыт №8
«Взаимодействие водорода и оксида меди (2)»
Цель: изучить некоторые химические свойства водорода, сформировать представление о водороде как восстановителе.
Оборудование и реактивы: спиртовка, пробирки, ток водорода, оксид меди.
Опыт. В сухую чистую пробирку поместите несколько кусочков (объем с горошину) оксида меди и наденьте на газоотводную трубку прибора для получения водорода таким образом, чтобы конец трубки находился у самого дна пробирки, а само дно должно быть чуть выше ее отверстия. Установите спиртовку под пробиркой с оксидом меди. Пропускайте ток водорода над оксидом меди. Что наблюдаете? Сделайте вывод.
Лабораторный опыт №9
«Взаимодействие основных оксидов с кислотами»
Цель: сформировать представления о свойствах классов неорганических соединений (кислот и оксидов).
Оборудование и реактивы: серная кислота, оксид меди, пробирка, спиртовка.
Опыт. В пробирку с кислотой добавляем оксид меди и слегка нагреваем ее. Что вы наблюдаете? О чем это говорит? Напишите уравнение соответствующей реакции. Сделайте вывод.
Лабораторный опыт №10
«Получение осадков нерастворимых гидроксидов и изучение их свойств»
Цель: получить осадки нерастворимых гидроксидов и изучить их свойства.
Оборудование и реактивы: пробирки, штатив-подставка, растворы сульфата меди (2), хлорида железа (3), хлорида натрия, хлорида кальция, растворы гидроксида натрия и гидроксида калия, вода, фенолфталеин.
Опыт 1. Налейте в пробирки по 1 мл растворов солей, добавьте в каждую по 3-4 капли раствора щелочи. Отметьте, с какими солями щелочь вступила в реакцию. По какому признаку определили, что реакция прошла? Каковы продукты этой реакции? Составьте уравнения соответствующих реакций. Сделайте вывод.
Опыт 2. Прилейте в пробирки по 3-4 мл воды и взболтайте. Посмотрите в каких пробирках осадки растворились, а в каких частично или совсем не растворились. К растворам добавьте по нескольку капель раствора фенолфталеина. Как изменилась окраска фенолфталеина? Почему? Сделайте вывод.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Лабораторные опыты по химии для 8 класса (81.25 KB)
Лабораторные опыты по химии для 8 класса (81.25 KB)
 0
0 376
376 3
3 Нравится
0
Нравится
0


