Отыщи всему начало, и ты многое поймёшь
Козьма Прутков
Тема урока: Строение атома. Опыт Резерфорда.
Тип урока: урок изучения нового материала.
Вид урока: стандартный урок.
Цель урока: изучить строение атома; рассмотреть фундаментальный опыт Резерфорда.
Задачи:
Образовательные:
Развивающая:
Воспитательные:
Оборудование: компьютер, проектор для показа набора слайдов: графические задания, портреты ученых, модели атомов Томсона и Резерфорда, Опыт Резерфорда (фрагмент), наглядные пособия.
Ход урока.
Подготовительная часть: оргмомент, постановка цели урока.
Основная часть:
1. Фронтальный опрос:
- Каковы были взгляды о строении вещества в древности?
- Как переводится с греческого слово «атом»?
- Какое явление стало свидетельством сложного строения атома?
- Кем и в каком году оно было открыто?
- В чем заключается явление радиоактивности?
- Кем и как проводился опыт по изучению состава радиоактивности?
- Как были названы частицы, входящие в состав радиоактивного излучения?
Как были названы частицы, входящие в состав радиоактивного излучения?
- По рисунку определите заряд и название каждого из трех лучей? Почему вы так считаете?
2. Актуализация знаний.
- Какие заряды существуют в природе?
- Каким образом они взаимодействуют друг с другом?
3. Изучение нового материала.
Слово “атом” придумал очень давно более 2500 лет назад древнегреческий философ Демокрит. С греческого “атом” переводится как “неделимый”. Так ли это?
В истории развития физики одна из самых интересных и увлекательных страниц – это история открытия сложного строения атома. В конце XIX- начале XX в. идеи о строении атома витали в воздухе, различные догадки ученых создавали духовную атмосферу, в которой, в конце концов, и рождалось открытие, ведь в то время ничего о внутреннем строении атома не было известно.
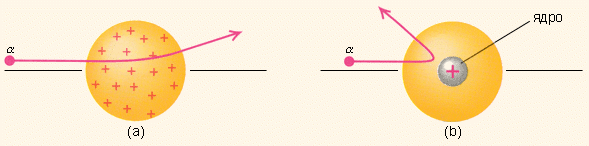









 После открытия в 1897 г. электрона, входящего в состав атома, был сделан вывод о сложном строении атома. Первая достаточно разработанная модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. Согласно этой модели вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны “вкраплены” в атом. Первая модель атома сыграла положительную роль. Но она требовала доказательств.
После открытия в 1897 г. электрона, входящего в состав атома, был сделан вывод о сложном строении атома. Первая достаточно разработанная модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. Согласно этой модели вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны “вкраплены” в атом. Первая модель атома сыграла положительную роль. Но она требовала доказательств.
Ч тобы проверить гипотезу Дж. Дж. Томсона необходимо провести эксперимент, что и сделал Э. Резерфорд. Он решил проникнуть внутрь атома с помощью α-частиц, которые имели положительный заряд, массу почти в 7300 раз большую чем масса электрона и очень большую скорость (около 20000км/c). С точки зрения Резерфорда α-частицы должны были легко "пробить" атом и тем самым доказать справедливость модели атома Томсона.
тобы проверить гипотезу Дж. Дж. Томсона необходимо провести эксперимент, что и сделал Э. Резерфорд. Он решил проникнуть внутрь атома с помощью α-частиц, которые имели положительный заряд, массу почти в 7300 раз большую чем масса электрона и очень большую скорость (около 20000км/c). С точки зрения Резерфорда α-частицы должны были легко "пробить" атом и тем самым доказать справедливость модели атома Томсона.
Е
 сли бы атом был устроен так, как предполагал Дж.Томсон, то Э.Резерфорд увидел бы следующую картину: α- частицы пробивают атом и практически не отклоняясь пролетают сквозь него.
сли бы атом был устроен так, как предполагал Дж.Томсон, то Э.Резерфорд увидел бы следующую картину: α- частицы пробивают атом и практически не отклоняясь пролетают сквозь него.
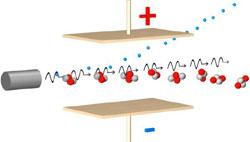
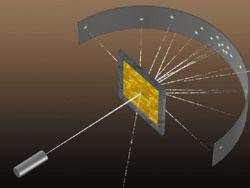
С хему экспериментальной установки Резерфорда вы видите на рисунке.
хему экспериментальной установки Резерфорда вы видите на рисунке.  В цилиндрическом сосуде с небольшим отверстием находился радиоактивный препарат, испускавший поток α-частиц. Они попадали на золотую фольгу и, проходя через нее, ударялись о люминесцирующий экран. В местах удара частиц на экране возникали вспышки света.
В цилиндрическом сосуде с небольшим отверстием находился радиоактивный препарат, испускавший поток α-частиц. Они попадали на золотую фольгу и, проходя через нее, ударялись о люминесцирующий экран. В местах удара частиц на экране возникали вспышки света.
То, что некоторые α-частицы отскакивали от фольги назад, противоречило модели Томсона. Результаты эксперимента настолько удивили Резерфорда, что он воскликнул: "... неправдоподобно так же, как если бы вы выстрелили пятнадцатифунтовым снарядом в папиросную бумагу, а снаряд отскочил бы обратно и убил бы вас самих".
Чтобы объяснить результаты опыта, Резерфорд рассуждал так. Известно, что α-частицы имеют положительный заряд. Если некоторые из них отталкиваются фольгой назад, значит, положительный заряд есть и в атомах фольги. Но поскольку бoльшая часть α-частиц пролетает сквозь фольгу, почти не отклоняясь при этом, значит, этот положительный заряд занимает лишь малую часть каждого атома. Ее назвали ядром атома.
П одсчитывая частицы, отклоняющиеся после пролета фольги на большие и малые углы, определили приблизительные размеры ядра: около 10-14 м. Это число оказалось примерно в 10 000- 100 000 раз меньше размеров самого атома. Поэтому свободное пространство в модели атома Резерфорд "заполнил" электронами Он, в частности, говорил, что атом "состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины".
одсчитывая частицы, отклоняющиеся после пролета фольги на большие и малые углы, определили приблизительные размеры ядра: около 10-14 м. Это число оказалось примерно в 10 000- 100 000 раз меньше размеров самого атома. Поэтому свободное пространство в модели атома Резерфорд "заполнил" электронами Он, в частности, говорил, что атом "состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины".
Наблюдавшееся Резерфордом рассеяние заряженных частиц и объясняется таким распределением зарядов в атоме При столкновениях с отдельными электронами α-частицы испытывают отклонения на очень небольшие углы, так как масса электрона мала. Однако в тех редких случаях, когда она пролетает на близком расстоянии от одного из атомных ядер, под действием сильного электрического поля ядра может произойти отклонение на большой угол.
Т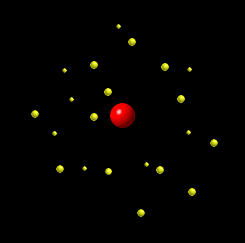 ак как большая часть пространства в атоме пуста, быстрые α-частицы могут почти свободно проникать через значительные слои вещества, содержащие несколько тысяч слоев атомов.
ак как большая часть пространства в атоме пуста, быстрые α-частицы могут почти свободно проникать через значительные слои вещества, содержащие несколько тысяч слоев атомов.
И так, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро. Размеры. Атом: 10-10 м; ядро: 10-10 – 10-14 м. Практически вся масса атома сосредоточена в ядре- 99,95 %. Из опытов следует, что ядро и отталкивает альфа-частицу, причем тем сильнее, чем ближе к ядру она проходит. По соотношению между общим числом частиц и числом отклонившихся на определенные углы частиц рассчитывается размер ядра и заряд ядра. Оказалось, что радиус ядра имеет порядок 10 - 12 см (10 - 14 м). Заряд же ядра положителен и определяется формулой q = Z•e, где Z - порядковый номер элемента в периодической системе, а е- модуль заряда электрона”.
так, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро. Размеры. Атом: 10-10 м; ядро: 10-10 – 10-14 м. Практически вся масса атома сосредоточена в ядре- 99,95 %. Из опытов следует, что ядро и отталкивает альфа-частицу, причем тем сильнее, чем ближе к ядру она проходит. По соотношению между общим числом частиц и числом отклонившихся на определенные углы частиц рассчитывается размер ядра и заряд ядра. Оказалось, что радиус ядра имеет порядок 10 - 12 см (10 - 14 м). Заряд же ядра положителен и определяется формулой q = Z•e, где Z - порядковый номер элемента в периодической системе, а е- модуль заряда электрона”.
Таким образом, на сегодня известно точно, что... (учитель - на доске, ребята - в тетради составляют схему-таблицу строения атома).
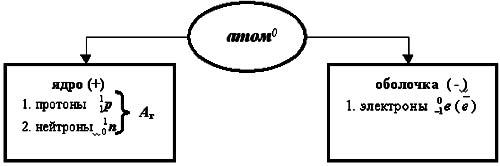
Строение всех атомов зашифровано в периодической системе химических элементов. Порядковый номер химического элемента показывает электрический заряд ядра атома Z , этот заряд численно равен сумме протонов в ядре атома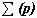 ; т.к. атом в целом электрически нейтральная частица, то суммарный положительный заряд атома равен суммарному отрицательному заряду, следовательно, равен числу электронов в оболочке атома
; т.к. атом в целом электрически нейтральная частица, то суммарный положительный заряд атома равен суммарному отрицательному заряду, следовательно, равен числу электронов в оболочке атома . Чтобы вычислить число нейтронов в ядре из массового числа атома вычитаем заряд ядра:
. Чтобы вычислить число нейтронов в ядре из массового числа атома вычитаем заряд ядра:
4. Отработка изученного материала проводится с помощью вопросов, предложенных в мультимедийном пособии, а также:
а) Опроверг ли своими опытами Э. Резерфорд модель атома Томсона?
б) задача с выбором ответа:
Опыты Резерфорда по рассеянию альфа-частиц показали:
электрон вращается в атоме по круговой орбите;
альфа-частицы положительно заряжены;
атом не взаимодействует с альфа-частицами;
атом состоит из малого по объему и массивного ядра и легких электронов;
атом состоит из заряженных частей.
Выберете правильный и исчерпывающий ответ.
в) заполняем таблицу вместе с учащимися
г) фронтальный опрос:
Чем отличаются протоны и электроны?
Сходство и различие протонов и нейтронов?
Какой заряд имеет атом меди?
Из чего складывается масса атома?
Предлагаем вашему вниманию сочинение. Как вы думаете, о чём идёт речь в сочинении?
Таким образом, в результате опытов по рассеянию α-частиц была доказана несостоятельность модели атома Томсона и выдвинута ядерная модель.
5. Выполнение тестовой работы на два варианта (задания на рабочем листе у каждого учащегося, работы сдаются для проверки)
Закрепление.
- С какой целью проводился опыт Резерфорда?
- Пользуясь рисунком расскажите, как проводился опыт Резерфорда по рассеянию α- частиц?
- Какие результаты были получены в ходе опыта?
- Каковы вывода Резерфорда?
- Что представляет атом согласно ядерной модели, выдвинутой Резерфордом?
- Каковы размеры атома и ядра?
- По рисунку расскажите, как проходят α- частицы сквозь атомы вещества? Почему?
З
Атом
аполните схему:


Ядро
Электронная оболочка

протоны

нейтроны
Самостоятельная работа (4 – 5 мин).
Вариант 1.
1. В состав ядра атома входят следующие частицы:
А) только протоны; В) протоны и электроны;
Б) нейтроны и протоны; Г) нейтроны и электроны.
2. Какой заряд имеют α – частица, β – частица?
А) α - частица – отрицательный, β – частица – положительный;
Б) α- и β- частицы – положительные;
В) α- частица – положительный, β – частица – отрицательный;
Г) α- и β- частицы – отрицательные.
3. Что такое α – излучение?
А) поток положительных ядер атома гелия;
Б) поток электронов;
В) поток нейтральных частиц;
Г) поток электромагнитного излучения
4. Современная модель структуры атома обоснована опытами:
А) по рассеянию α- частиц;
Б) по сжимаемости жидкости;
В) по электризации;
Г) по тепловому расширению.
5. Кто предложил ядерную модель строения атома?
А) Беккерель; В) Кюри;
Б) Томсон; Г) Резерфорд.
6. По современным представлениям атом – это:
А) маленькая копия молекулы вещества;
Б) мельчайшая частица молекулы вещества;
В) однородный положительный шар с вкраплениями электронов;
Г) положительно заряженное ядро, вокруг которого движутся электроны.
7. С помощью опытов Резерфорд установил, что:
А) положительный заряд распределен равномерно по всему объему атома;
Б) положительный заряд сосредоточен в центре атома и имеет малый объем;
В) в состав атома входят электроны;
Г) атом не имеет внутренней структуры.
Вариант 2.
1. С помощью опытов Резерфорд установил, что:
А) положительный заряд распределен равномерно по всему объему атома;
Б) положительный заряд сосредоточен в центре атома и имеет малый объем;
В) в состав атома входят электроны;
Г) атом не имеет внутренней структуры.
2. Какой заряд имеют γ – частица, β – частица?
А) β- частица – положительный, γ- излучение – отрицательный;
Б) β- частица – отрицательный, γ- излучение – не имеет заряда;
В) γ- и β- частицы – положительный;
Г) β – частица не имеет заряда, γ- излучение – положительный.
3. Кто открыл явление радиоактивности?
А) М. Кюри; В) Э. Резерфорд;
Б) ДЖ. Томсон; Г) А. Беккерель.
4. Что такое β – излучение?
А) поток положительных ядер атома гелия;
Б) поток электронов;
В) поток нейтральных частиц;
Г) поток электромагнитного излучения.
5. Из каких частиц состоят ядра атомов?
А) из протонов;
Б) из нейтронов;
В) из протонов и нейтронов;
Г) из протонов, нейтронов и электронов.
6. Что такое γ – излучение?
А) поток положительных ядер атома гелия;
Б) поток электронов;
В) поток нейтральных частиц;
Г) поток электромагнитного излучения.
7.Современная модель структуры атома обоснована опытами:
А) по рассеянию α- частиц; В) по электризации;
Б) по сжимаемости жидкости; Г) по тепловому расширению.
Подведение итогов.
Вернемся к эпиграфу урока: «Отыщи всему начало, и ты многое поймёшь». Я думаю, что на сегодняшнем уроке «начало» мы отыскали. А многое понять и узнать нам предстоит на наших следующих уроках.
На волне открытий строения атома поэт Валерий Брюсов в 1922 году написал стихотворение “Мир электрона”, в котором провел аналогию между строением атома и Солнечной системы.
Мир электрона.
Быть может, эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков.
Еще, быть может, каждый атом -
Вселенная, где сто планет,
Там все, что здесь, в объеме сжатом,
Но так же то, чего здесь нет.
Их меры малы, но все та же
Их бесконечность, как и здесь,
Там скорбь и страсть, как здесь, и даже
Там та же мировая спесь...
Д/з. § 93.
Приложение 1
Тема урока: "Строение атома"
Рабочий лист

1. Демокрит (др. греч.): 2. Модель Дж. Дж. Томсона: «атом» - « ». (дорисуй модель)

3. Планетарная модель атома:
1. -
2. -
4. Заполни схему: «Состав атома».

5.Заполни таблицу:
6. Ответьте на вопрос: Что произойдёт с атомом, если изменить количество электронов?
1 H0 - 1
H0 - 1 → 1H+1 ? _____________________________
→ 1H+1 ? _____________________________
1 H0 + 1
H0 + 1 → 1H-1 ? ____________________________
→ 1H-1 ? ____________________________
Частицы, которые получились при отдаче (потере) и принятии (присоединении)  и приобрели заряд, называются ионами.
и приобрели заряд, называются ионами.
Атомы одного вида, но имеющие разные числа нейтронов (разные массы), называются изотопами.
___________________
З акончи предложение:
акончи предложение:
Если бы не было открыто строение атома, то _______________________
____________________________________________________________________________________________________________________________________
10.Домашнее задание § 93.
Заполни таблицу:
| химические элементы | ядро | Электроны, |
| Протоны, p | Нейтроны, n |
| О |
|
|
|
| В |
|
|
|
| Na |
|
|
|
| Hg |
|
|
|
| Al |
|
|
|
10

 Получите свидетельство
Получите свидетельство Вход
Вход



 Как были названы частицы, входящие в состав радиоактивного излучения?
Как были названы частицы, входящие в состав радиоактивного излучения?





 После открытия в 1897 г. электрона, входящего в состав атома, был сделан вывод о сложном строении атома. Первая достаточно разработанная модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. Согласно этой модели вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны “вкраплены” в атом. Первая модель атома сыграла положительную роль. Но она требовала доказательств.
После открытия в 1897 г. электрона, входящего в состав атома, был сделан вывод о сложном строении атома. Первая достаточно разработанная модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. Согласно этой модели вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны “вкраплены” в атом. Первая модель атома сыграла положительную роль. Но она требовала доказательств. тобы проверить гипотезу Дж. Дж. Томсона необходимо провести эксперимент, что и сделал Э. Резерфорд. Он решил проникнуть внутрь атома с помощью α-частиц, которые имели положительный заряд, массу почти в 7300 раз большую чем масса электрона и очень большую скорость (около 20000км/c). С точки зрения Резерфорда α-частицы должны были легко "пробить" атом и тем самым доказать справедливость модели атома Томсона.
тобы проверить гипотезу Дж. Дж. Томсона необходимо провести эксперимент, что и сделал Э. Резерфорд. Он решил проникнуть внутрь атома с помощью α-частиц, которые имели положительный заряд, массу почти в 7300 раз большую чем масса электрона и очень большую скорость (около 20000км/c). С точки зрения Резерфорда α-частицы должны были легко "пробить" атом и тем самым доказать справедливость модели атома Томсона. 
 сли бы атом был устроен так, как предполагал Дж.Томсон, то Э.Резерфорд увидел бы следующую картину: α- частицы пробивают атом и практически не отклоняясь пролетают сквозь него.
сли бы атом был устроен так, как предполагал Дж.Томсон, то Э.Резерфорд увидел бы следующую картину: α- частицы пробивают атом и практически не отклоняясь пролетают сквозь него.  хему экспериментальной установки Резерфорда вы видите на рисунке.
хему экспериментальной установки Резерфорда вы видите на рисунке.  одсчитывая частицы, отклоняющиеся после пролета фольги на большие и малые углы, определили приблизительные размеры ядра: около 10-14 м. Это число оказалось примерно в 10 000- 100 000 раз меньше размеров самого атома. Поэтому свободное пространство в модели атома Резерфорд "заполнил" электронами Он, в частности, говорил, что атом "состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины".
одсчитывая частицы, отклоняющиеся после пролета фольги на большие и малые углы, определили приблизительные размеры ядра: около 10-14 м. Это число оказалось примерно в 10 000- 100 000 раз меньше размеров самого атома. Поэтому свободное пространство в модели атома Резерфорд "заполнил" электронами Он, в частности, говорил, что атом "состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины".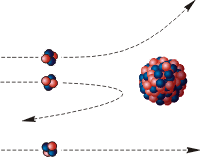
 ак как большая часть пространства в атоме пуста, быстрые α-частицы могут почти свободно проникать через значительные слои вещества, содержащие несколько тысяч слоев атомов.
ак как большая часть пространства в атоме пуста, быстрые α-частицы могут почти свободно проникать через значительные слои вещества, содержащие несколько тысяч слоев атомов. так, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро. Размеры. Атом: 10-10 м; ядро: 10-10 – 10-14 м. Практически вся масса атома сосредоточена в ядре- 99,95 %. Из опытов следует, что ядро и отталкивает альфа-частицу, причем тем сильнее, чем ближе к ядру она проходит. По соотношению между общим числом частиц и числом отклонившихся на определенные углы частиц рассчитывается размер ядра и заряд ядра. Оказалось, что радиус ядра имеет порядок 10 - 12 см (10 - 14 м). Заряд же ядра положителен и определяется формулой q = Z•e, где Z - порядковый номер элемента в периодической системе, а е- модуль заряда электрона”.
так, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро. Размеры. Атом: 10-10 м; ядро: 10-10 – 10-14 м. Практически вся масса атома сосредоточена в ядре- 99,95 %. Из опытов следует, что ядро и отталкивает альфа-частицу, причем тем сильнее, чем ближе к ядру она проходит. По соотношению между общим числом частиц и числом отклонившихся на определенные углы частиц рассчитывается размер ядра и заряд ядра. Оказалось, что радиус ядра имеет порядок 10 - 12 см (10 - 14 м). Заряд же ядра положителен и определяется формулой q = Z•e, где Z - порядковый номер элемента в периодической системе, а е- модуль заряда электрона”.









 Конспект урока по физике "Строение атома. Опыт Резерфорда" (0.35 MB)
Конспект урока по физике "Строение атома. Опыт Резерфорда" (0.35 MB)
 0
0 1871
1871 310
310 Нравится
0
Нравится
0


