
«кислород, его характеристика и значение»
«Кислород- это вещество, вокруг которого вращается земная химия»
Я.Берцелиус
Автор: учитель МОУ «Зенинская средняя общеобразовательная школа»
Пушкарёва Татьяна Васильевна

Цель урока: закрепить и углубить знания по характеристике кислорода и значению
- Задачи урока:
1.Обобщить и систематизировать пройденный материал по теме: “Кислород”. 2.Закрепить знания о роли кислорода в природе и жизни человека, решение экологических проблем. 3.Отработать практические навыки работы с химическим оборудованием и реактивами. 4.Воспитывать у учащихся культуру речи, поведения. 5.Возбудить интерес к дальнейшей учебной деятельности, снять напряжённость при ответах в присутствии “гостей”.

История открытия кислорода
- Английский ученый Джорж Пристли в 1774 году, изучая газы, при разложении оксида ртути получил газ , который поддерживал горение и назвал его воздухом

Состав воздуха
По – настоящему оценил кислород и дал ему название французский химик Антуан Лоран Лавуазье. Он установил, что воздух состоит из двух частей:
Жизненный воздух- oxigenium-кислород,
Безжизненный- nitrogenium- азот.

I .Общая характеристика кислорода.
Химический знак …..
Относительная атомная масса Ar … Химическая формула … Относительная молекулярная масса Mr … Валентность равна …
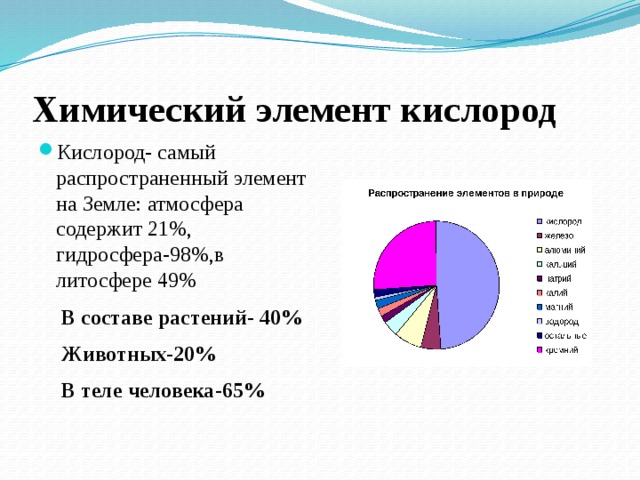
Химический элемент кислород
- Кислород- самый распространенный элемент на Земле: атмосфера содержит 21%, гидросфера-98%,в литосфере 49%
В составе растений- 40%
Животных-20%
В теле человека-65%

Состав воздуха
Азот 78%
Кислород 21%
Аргон 0,93%
Углекислый газ 0,03%
0,01% приходится на долю всех остальных газов - водорода, гелия, неона, криптона, ксенона, радона.
Атомы кислорода могут соединяться между собой с образованием озона,
формула которого О 3 .

Изменение состава воздуха
Природные факторы:
- извержение вулканов
- пыльные бури
- морская вода и соли
- лесные пожары
Хозяйственная деятельность человека:
транспорт,
тепловые электростанции,
горящие свалки ,
выбросы химических заводов

Экологические расчёты по примерному расходованию кислорода автотранспортом по улице Школьная в течение 1 часа
- За 15 мин.отмечено 19 автомобилей. За 1 час соответственно 19 х 4 = 76 автомобилей. Длина улицы 900 м . Общий путь всех автомобилей находим по формуле
- S= 76 х 900 м = 68 4 00 м = 68.4 км
- Известно, что на 100 км автомобиль расходует 262, 8 м.куб. кислорода (человек за год при дыхании использует такое количество). Составляем пропорцию и расчитываем количество кислорода ,которое расходуется на 68, 4 км
- 100 км - 262, 8 м.куб.
68,4 км - Х м.куб. Х= 179.8 м.куб.

- Мы решили вычислить, на сколько часов хватило бы сожжённого автомобилями кислорода ( 179. 8 м.куб) нашему классу для дыхания:
- За1 мин1чел.использует для дыхания 0,5 дм куб
- 1 час - 30 дм куб
- За 1 час 21 чел. потребляет - 630дм куб
- 179800дм куб : 630 дм = 285часов
- На сколько суток хватит этого кислорода 8 классу для дыхания ? 285 часов : 24 часа = 12 суток

IV. Получение кислорода
- В природе кислород образуется в процессе фотосинтеза. 6СО 2 +6 Н 2 О = С 6 Н 12 О 6 + 6О 2
- В промышленности его получают перегонкой сжиженного воздуха при температуре – 183 С.

IV. Получение кислорода
Лабораторный способ получения:
- 1.Разложение пероксида водорода под действием
МnО 2
Н 2 О 2 = … + …
- 2.Разложение перманганата калия при нагревании.
2КМnО 4 =… + … + …
3. Разложение воды постоянным электрическим током
Н 2 О = … + …

Физические свойства
Бесцветный газ, без вкуса, запаха, малорастворим в воде.
- При температуре -183 о С превращается в подвижную жидкость.
- При температуре - 218 затвердевает
- Жидкий кислород – голубого цвета
- Кристаллический – синего.

Химические свойства кислорода
- Реакция горения угля
С+О 2 =…
- Реакция горения серы
S+O 2 =…
- Реакция горения фосфора
Р+О 2 = …

Свойство кислорода: поддерживает горение и медленное окисление;
- Взаимодействие веществ с кислородом относится к реакциям окисления, образует оксиды.
- Оксиды – сложные вещества, которые состоят из двух элементов, одним из которых является кислород.

Задание для 2 группы Для веществ СН 4 , К , Zn
- 1 Запишите реакцию горения . 2. Расставьте коэффициенты. 3. Дайте название полученным веществам. 4. Определите количество кислорода в уравнении.

Задание для 1 группы Вещество SO 3, NO2
- Дайте название веществу.
- Определите валентность каждого элемента в веществе.
- Вычислите относительную молекулярную массу вещества.
- Вычислите массовую долю кислорода в веществе.

Задание для 3 группы H 2 S0 4 , ZпO, HCI, NaOH, H 2 , CaO, S0 2 , K 2 C0 3 , N0 2 , Cu, NaN0 3 ,, Fe 2 0 3 , ZnS, H 2 0, H 2 S.
- Выпишите из данного списка формулы оксидов
- .Определите валентность элементов.
- Дайте названия оксидам.
- Назовите оксиды, где Элемент проявляет валентность I, II, III, IV.

Задание « Найди пару » Соедини линиями формулу оксида с соответствующим ему названием.
Формула оксида
Название оксида
P 2 O 5
Оксид кальция
SO 2
Оксид бария
CO 2
Оксид железа III
NO
Оксид цинка
K 2 O
Оксид фосфора V
Fe 2 O 3
Оксид серы IV
ZnO
Оксид углерода IV
CaO
Оксид азота II
BaO
Оксид калия

Применение кислорода

Рефлексивный тест 1. Узнал много нового. 2. Мне это пригодится в жизни. 3. На поставленные вопросы я получил ответы. 4. На уроке работал с интересом,
да
Не т

Домашнее задание: Задача №1 стр. 60, упр. 7 стр. 69

 Получите свидетельство
Получите свидетельство Вход
Вход












 Кислород, характеристика, свойства (430.57 KB)
Кислород, характеристика, свойства (430.57 KB)
 0
0 733
733 16
16 Нравится
0
Нравится
0


