
Типы
химических
реакций
в органической
химии

Реакции органических веществ можно разделить на четыре типа:
- Замещения;
- Присоединения;
- Отщепления (элиминирования);
- Перегруппировки (изомеризации)
Субстрат – это главное органическое вещество, которое участвует в реакции.
Реагент – это другой компонент этой реакции.

Реакции замещения - это реакции,
в ходе которых атомы или группы
атомов в исходной молекуле
замещаются
на другие атомы или группы атомов

Реакции замещения
- Характерны для веществ, имеющих простые одинарные связи.
- Происходят при сильном освещении, так как при освещении образуются свободные радикалы , которые и инициируют реакцию.
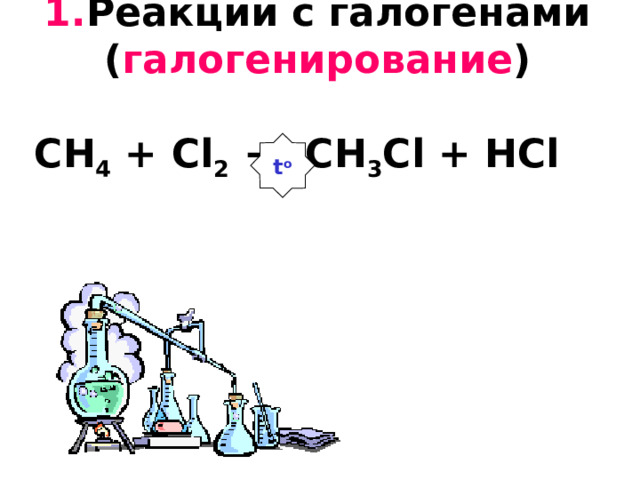
1. Реакции с галогенами ( галогенирование ) CH 4 + Cl 2 → CH 3 Cl + HCl
t o
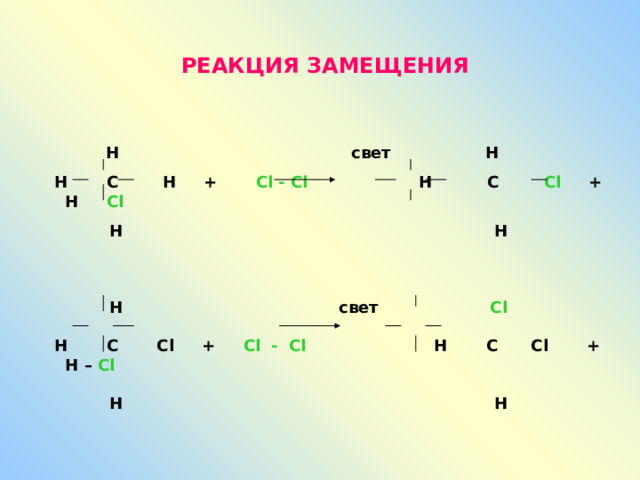
РЕАКЦИЯ ЗАМЕЩЕНИЯ
Н свет Н
Н С Н + Cl - Cl Н С С l + Н С l
Н Н
Н свет С l
Н С С l + Cl - Cl Н С С l + Н – Cl
Н Н
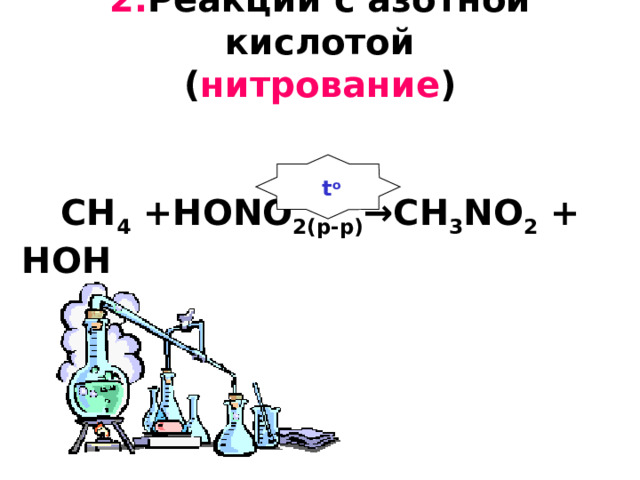
2. Реакции с азотной кислотой ( нитрование ) CH 4 +HONO 2 (р-р) →CH 3 NO 2 + HOH
t o

Реакции присоединения –
это реакции,
в ходе которых
молекулы реагирующих
веществ соединяются в одну

Реакции присоединения
Происходят с веществами, у которых есть двойные или тройные связи.
Эти вещества называются алкены и алкины, так, например, этен С 2 Н 4 и этин С 2 Н 2
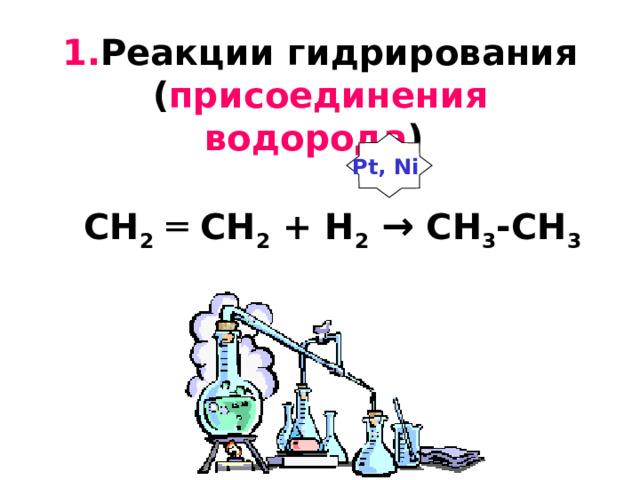
1. Реакции гидрирования ( присоединения водорода ) CH 2 ═ CH 2 + H 2 → CH 3 -CH 3
Pt, Ni
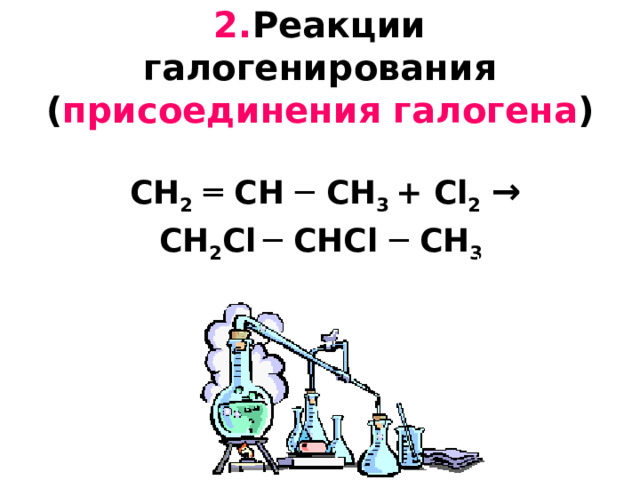
2. Реакции галогенирования ( присоединения галогена ) CH 2 ═ CH ─ CH 3 + С l 2 → CH 2 С l ─ CH С l ─ CH 3
![Реакция присоединения СН 2 СН 2 + С l С l СН 2 СН 2 Cl Cl ] СН СН + Cl Cl Cl Cl CH CH Cl Cl CH CH + Cl Cl Cl Cl CH CH Cl Cl](https://fsd.videouroki.net/html/2023/11/18/v_65582c1be3c34/img11.jpg)
Реакция присоединения
СН 2 СН 2 + С l С l СН 2 СН 2
Cl Cl
]
СН СН + Cl Cl Cl Cl
CH CH
Cl Cl
CH CH + Cl Cl Cl Cl
CH CH
Cl Cl
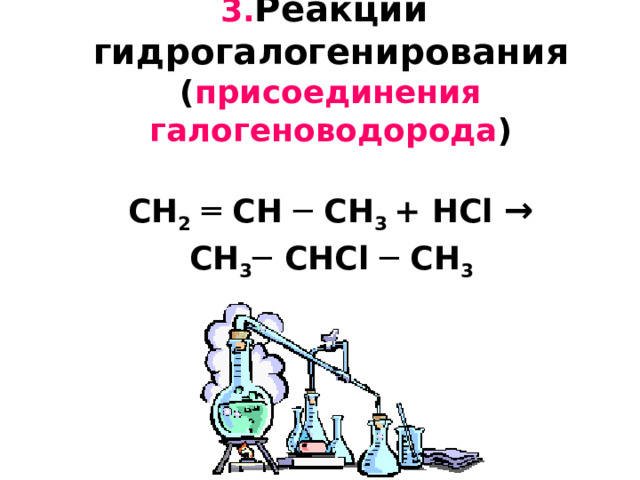
3. Реакции гидрогалогенирования ( присоединения галогеноводорода ) CH 2 ═ CH ─ CH 3 + H С l → CH 3 ─ CH С l ─ CH 3

Алкены
Правило Марковникова В.В . – присоединение галогеноводородов к несимметричным алкенам – водород галогеноводорода присоединяется к атому углерода, содержащий большее число атомов водорода (более гидрированный).
СН3 – СН=СН2 + НС l → CH3 –CHCl – CH3
пропен-1 2-хлорпропан
По правилу Марковникова протекает реакция гидратации алкенов.
СН3 – СН=СН2 + Н2О → CH3 –CH (ОН) – CH3
пропен-1 пропанол - 2
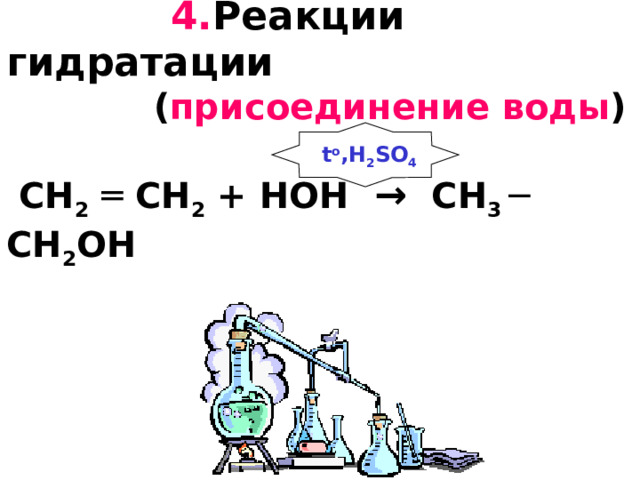
4. Реакции гидратации ( присоединение воды ) CH 2 ═ CH 2 + HOH → CH 3 ─ CH 2 OH
t o ,H 2 SO 4
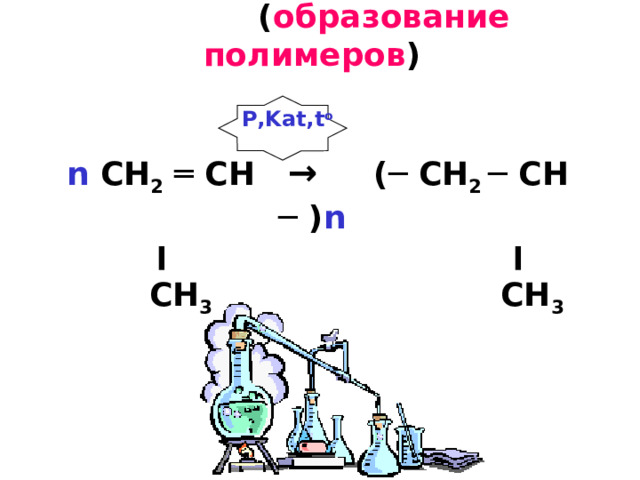
5. Реакции полимеризации ( образование полимеров ) n CH 2 ═ CH → (─ CH 2 ─ CH ─ ) n ׀ ׀ CH 3 CH 3
P,Kat,t o

Реакции
отщепления ( элиминирования ) –
это реакции, в ходе которых из одной
молекулы исходного
вещества образуется несколько
новых
веществ
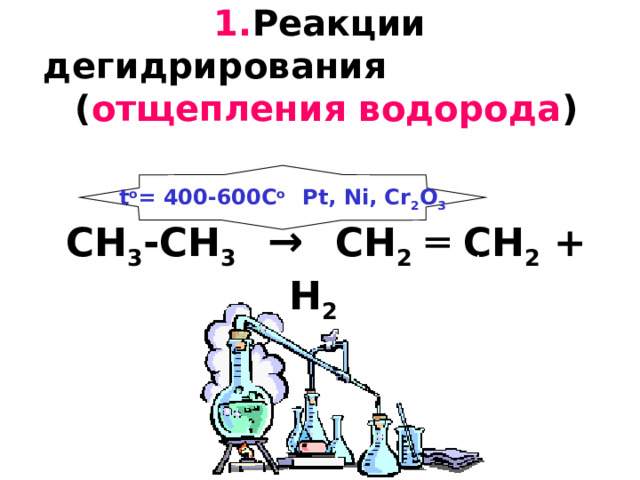
1. Реакции дегидрирования ( отщепления водорода ) CH 3 -CH 3 → CH 2 ═ CH 2 + H 2
t o = 400-600C o Pt, Ni, Cr 2 O 3
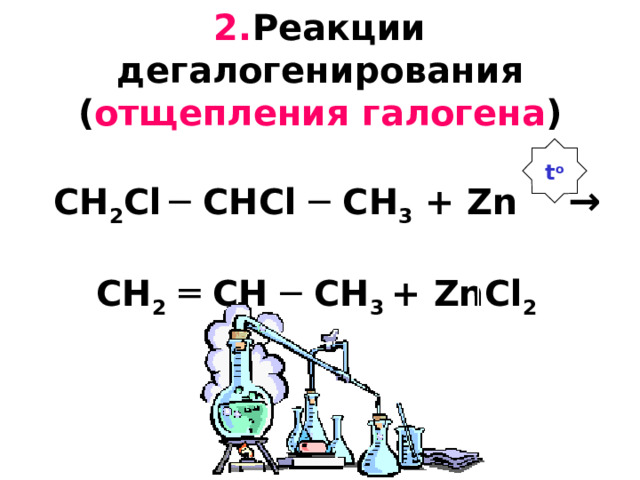
2. Реакции дегалогенирования ( отщепления галогена ) CH 2 С l ─ CH С l ─ CH 3 + Zn → CH 2 ═ CH ─ CH 3 + ZnCl 2
t o
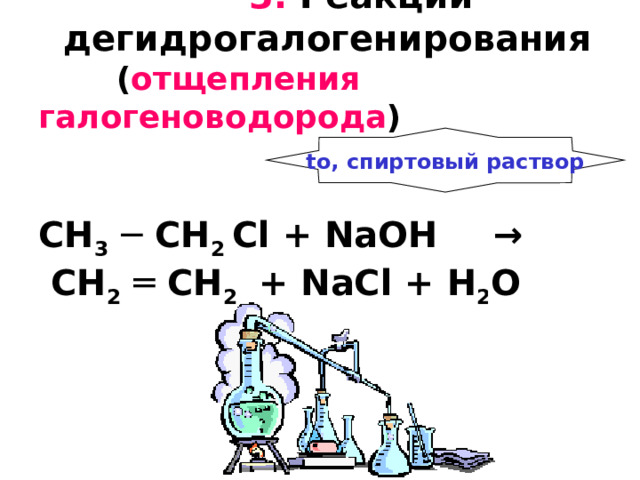
3. Реакции дегидрогалогенирования ( отщепления галогеноводорода ) CH 3 ─ CH 2 С l + NaOH → CH 2 ═ CH 2 + NaCl + H 2 O
to, спиртовый раствор

Правило Зайцева А.М.: атом водорода отщепляется от наименеее гидрогенизированного (с меньшим числом водородных атомом) атома углерода, т.е. образуется алкен с большим числом алкильных заместителей при двойной связи.
При нагревании спиртов в присутствии концентрированной серной кислоты до температуры выше 180 ° С происходит внутримолекулярное отщепление воды с образованием этиленового углеводорода :
 140 C o ,H 2 SO 4 " width="640"
140 C o ,H 2 SO 4 " width="640"
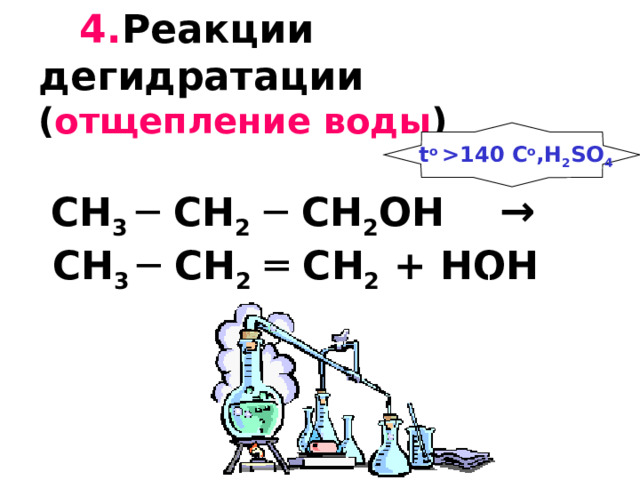
4. Реакции дегидратации ( отщепление воды ) CH 3 ─ CH 2 ─ CH 2 OH → CH 3 ─ CH 2 ═ CH 2 + HOH
t o 140 C o ,H 2 SO 4
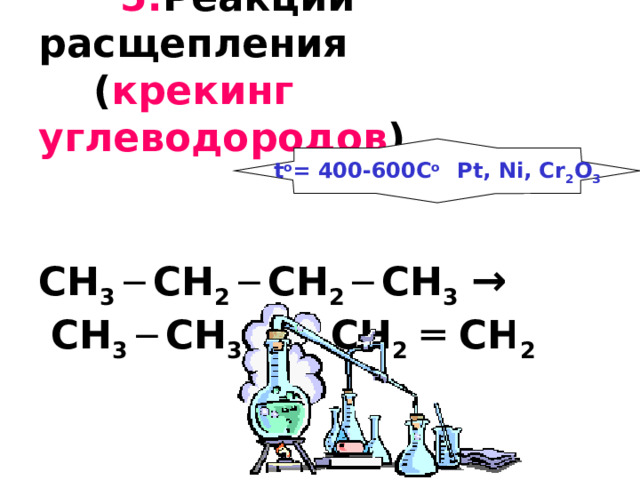
5. Реакции расщепления ( крекинг углеводородов ) CH 3 ─ CH 2 ─ CH 2 ─ CH 3 → CH 3 ─ CH 3 + CH 2 ═ CH 2
t o = 400-600C o Pt, Ni, Cr 2 O 3

Реакции изомеризации –
это реакции образования
изомеров органических
соединений
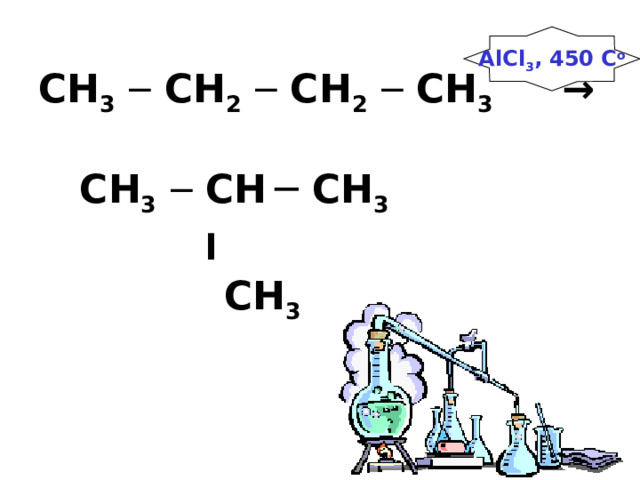
CH 3 ─ CH 2 ─ CH 2 ─ CH 3 → CH 3 ─ CH ─ CH 3 ׀ CH 3
AlCl 3 , 450 C o

Проверь себя:
- Как называются реакции, которые происходят с органическими веществами?
- Каковы условия реакций присоединения?
- Каковы условия реакций замещения?
- Что называется свободным радикалом?
- Напиши реакцию между пропаном и бромом, какой тип химической реакции?

 Получите свидетельство
Получите свидетельство Вход
Вход












 Химические реакции в органической химии (411 KB)
Химические реакции в органической химии (411 KB)
 0
0 219
219 5
5 Нравится
0
Нравится
0


